Diabetes medication/ja: Difference between revisions
Created page with "典型的な糖化ヘモグロビン (A1C)値の減少は1.5-2.0%である。いくつかの例がある: * ロシグリタゾン(アバンディア):2010年9月、欧州医薬品庁は心血管系リスクの上昇を理由にEUでの販売停止を勧告した。 * ピオグリタゾン(アクトス):現在も販売されているが、心血管系..." Tags: Mobile edit Mobile web edit |
Created page with "ロシグリタゾンの安全性に関する懸念は、レトロスペクティブなメタアナリシスがNew England Journal of Medicineに発表されたときに生じた。それ以来、かなりの数の論文が発表され、食品医薬品局の委員会は、賛否両論あったが、利用可能な研究が「有害性のシグナルを支持する」と20:3で投票した..." Tags: Mobile edit Mobile web edit |
||
| Line 84: | Line 84: | ||
</div> | </div> | ||
ロシグリタゾンの安全性に関する懸念は、レトロスペクティブなメタアナリシスが[[:en:the New England Journal of Medicine|New England Journal of Medicine]]に発表されたときに生じた。それ以来、かなりの数の論文が発表され、[[Food and Drug Administration/ja|食品医薬品局]]の委員会は、賛否両論あったが、利用可能な研究が「有害性のシグナルを支持する」と20:3で投票したが、22:1で薬剤の上市を維持することに投票した。このメタアナリシスは、この問題を評価するために計画された試験の中間解析では支持されなかった。[[glycemic control/ja|血糖コントロール]]に対するロシグリタゾンの重要かつ持続的な効果にもかかわらず、この副作用に関する弱いエビデンスは、ロシグリタゾンの使用を減少させた。安全性の研究は継続されている。 | |||
<div lang="en" dir="ltr" class="mw-content-ltr"> | <div lang="en" dir="ltr" class="mw-content-ltr"> | ||
Revision as of 14:53, 4 February 2024
糖尿病に用いられる薬剤は、血中グルコース濃度を低下させることによって糖尿病を治療する。インスリン、ほとんどのGLP受容体作動薬(リラグルチド、エキセナチドなど)、およびプラムリンチドを除き、すべて経口投与されるため、経口血糖降下薬または経口血糖降下薬とも呼ばれる。血糖降下薬にはさまざまなクラスがあり、糖尿病の性質、年齢、患者の状況などによって選択される。
[[[Diabetes mellitus type 1/ja|1型糖尿病]]は、インスリンの不足によって引き起こされる病気である。1型ではインスリンを注射しなければならない。
2型糖尿病は、細胞によるインスリン抵抗性の病気である。2型糖尿病は糖尿病の中で最も一般的なタイプである。治療には、(1)膵臓から分泌されるインスリンの量を増加させる薬剤、(2)標的臓器のインスリンに対する感受性を増加させる薬剤、(3)グルコースが消化管から吸収される速度を減少させる薬剤、(4)排尿によるグルコースの損失を増加させる薬剤が含まれる。
2型糖尿病には、主に経口投与されるいくつかの薬剤群が有効であり、しばしば併用される。2型糖尿病における治療薬の組み合わせには、複数のインスリンアイソフォームや経口抗高血糖薬が含まれることがある。2020年現在、23のユニークな抗高血糖薬の組み合わせがFDAによって承認されている。経口抗糖尿病薬の最初のトリプルコンビネーションが2019年に承認され、メトホルミン、サキサグリプチン、ダパグリフロジンからなる。2020年には、メトホルミン、リナグリプチン、エンパグリフロジンの別の3剤併用の承認が続いた。
作用機序=
糖尿病治療薬には主に4つの作用機序がある:
- インスリン感作作用: 細胞上のインスリン受容体の感受性を高めることにより、インスリン抵抗性を低下させ、血糖値に対するインスリンの効果を高める。
- β細胞の刺激: この刺激により、膵臓のβ細胞からのインスリン分泌が増加する。
- α-グルコシダーゼ阻害: α-グルコシダーゼ酵素を阻害すると、グルコースが消化管から吸収される速度が低下する。
- SGLT2阻害: ナトリウム-グルコース連結輸送体2(SGLT2)タンパク質の阻害は、ネフロンの腎尿細管へのグルコース再吸収を減少させ、尿中に排泄されるグルコース量を増加させる。
インスリン
インスリンは通常、注射またはインスリンポンプによって皮下投与される。急性期医療では、インスリンは静脈内投与されることもある。インスリン製剤は通常、体内で代謝される速度によって特徴付けられ、作用のピーク時間と持続時間が異なる。速効性インスリン製剤はすぐにピークに達し、その後代謝されるが、長時間作用型インスリン製剤はピーク時間が長く、体内でより長い期間活性を維持する傾向がある。
速効性インスリン(~1時間でピーク)の例としては、以下のものがある:
- インスリンリスプロ(ヒューマログ
- インスリンアスパルト(ノボログ)
- インスリングルリシン(アピドラ)
短時間作用型インスリン(ピーク2~4時間)の例としては、以下のようなものがある:
- 通常のインスリン(ヒューマリンR、ノボリンR)
- 即効性インスリン亜鉛(セミレンテ)
中間作用型インスリン(ピーク4~10時間)の例としては、以下のようなものがある:
- イソフェンインスリン、中性プロタミンヘゲドホルン(NPH)(ヒューマリンN、ノボリンN)
- インスリン亜鉛(レンテ)
長時間作用型インスリン(持続時間24時間、多くの場合ピークなし)の例としては、以下のようなものがある:
- 延長インスリン亜鉛インスリン(ウルトラメンテ)
- インスリングラルギン(ランタス)
- インスリンデテミル(レベミル)
- インスリンデグルデック(トレシーバ)
インスリンデグルデクは、他の長時間作用型インスリン製剤の多くが24時間であるのに対し、作用時間が約42時間であることから、「超長時間」作用型インスリンとして別分類されることもある。
インスリンデテミル、インスリン グラルギン、インスリン デグルデク、NPHインスリンを比較した研究のシステマティックレビューでは、夜間低血糖、重症低血糖、糖化ヘモグロビン、A1c、非致死的心筋梗塞/脳卒中、健康関連QOL、全死亡について、特定のインスリン製剤の明確な有益性や重篤な有害事象は示されなかった。A1c、非致死的心筋梗塞/脳卒中、QOL(Quality of Life:医療)|健康関連QOL、または全死亡であった。同じレビューでは、これらのインスリンアナログを使用することによる効果について、成人と小児の間に差は認められなかった。
ほとんどの経口糖尿病治療薬は妊娠禁忌であり、インスリンが望ましい。
インスリンは他の経路では投与されていないが、研究はされている。吸入製剤が一時認可されたが、その後撤回された。
増感剤=
インスリン感作薬は、2型糖尿病の中心的な問題であるインスリン抵抗性に対処する。
ビグアナイド
ビグアナイド系薬剤は、肝のグルコース産生を減少させ、骨格筋を含む末梢でのグルコースの取り込みを増加させる。肝臓や腎臓の機能が低下している患者には慎重に使用しなければならないが、ビグアナイド系薬剤であるメトホルミンは、小児や10代の2型糖尿病に最もよく使用される薬剤となっている。一般的な糖尿病治療薬の中で、メトホルミンは体重増加を引き起こさない唯一の広く使われている経口薬である。
メトホルミンによる糖化ヘモグロビン (A1C)値の典型的な減少は1.5~2.0%である。
- メトホルミン(グルコファージ)は、心不全のある患者には最良の選択かもしれないが、ヨード化静脈内注射を伴うX線撮影手技の前には一時中止すべきである。乳酸アシドーシスのリスクが高まるためである。
- フェンフォルミン(DBI)は、1960年代から1980年代までが使用されていたが、乳酸アシドーシスのリスクがあるため中止された。
- ブホルミンも乳酸アシドーシスのリスクにより中止された。
メトホルミンは通常、2型糖尿病治療の第一選択薬である。以前は食事療法や運動療法がうまくいかなかった後に処方されていたのとは対照的に、一般的には初診時に運動療法や減量療法と併用して処方される。即放性製剤と徐放性製剤があり、通常、胃腸副作用を経験している患者にのみ使用される。また、他の経口糖尿病薬との併用も可能である。
チアゾリジン系化合物
[Thiazolidinedione/ja|チアゾリジンジオン]]類(TZD類)は、「グリタゾン」としても知られ、グルコースおよび脂肪代謝を調節する遺伝子の転写に関与する核内制御タンパク質の一種であるペルオキシソーム増殖因子活性化受容体γ、PPARγに結合する。これらのPPARはペルオキシソーム増殖因子応答性エレメント(PPRE)に作用する。PPREはインスリン感受性遺伝子に影響を与え、インスリン依存性酵素のmRNAの産生を促進する。その結果、細胞によるグルコースの利用が促進される。これらの薬剤はまた、PPAR-α活性を増強し、HDLとLDLのいくつかの大きな成分の上昇をもたらす。
典型的な糖化ヘモグロビン (A1C)値の減少は1.5-2.0%である。いくつかの例がある:
- ロシグリタゾン(アバンディア):2010年9月、欧州医薬品庁は心血管系リスクの上昇を理由にEUでの販売停止を勧告した。
- ピオグリタゾン(アクトス):現在も販売されているが、心血管系リスクの上昇と関連している。
- トログリタゾン(レズリン):1990年代に使用されたが、肝炎と肝障害のリスクがあるため中止された。
Multiple retrospective studies have resulted in a concern about rosiglitazone's safety, although it is established that the group, as a whole, has beneficial effects on diabetes. The greatest concern is an increase in the number of severe cardiac events in patients taking it. The ADOPT study showed that initial therapy with drugs of this type may prevent the progression of disease, The American Association of Clinical Endocrinologists (AACE), which provides clinical practice guidelines for management of diabetes, retains thiazolidinediones as recommended first, second, or third line agents for type 2 diabetes mellitus, as of their 2019 executive summary, over sulfonylureas and α-glucosidase inhibitors. However, they are less preferred than GLP-1 agonists or SGLT2 inhibitors, especially in patients with cardiovascular disease (which liraglutide, empagliflozin, and canagliflozin are all FDA approved to treat).
ロシグリタゾンの安全性に関する懸念は、レトロスペクティブなメタアナリシスがNew England Journal of Medicineに発表されたときに生じた。それ以来、かなりの数の論文が発表され、食品医薬品局の委員会は、賛否両論あったが、利用可能な研究が「有害性のシグナルを支持する」と20:3で投票したが、22:1で薬剤の上市を維持することに投票した。このメタアナリシスは、この問題を評価するために計画された試験の中間解析では支持されなかった。血糖コントロールに対するロシグリタゾンの重要かつ持続的な効果にもかかわらず、この副作用に関する弱いエビデンスは、ロシグリタゾンの使用を減少させた。安全性の研究は継続されている。
In contrast, at least one large prospective study, PROactive 05, has shown that pioglitazone may decrease the overall incidence of cardiac events in people with type 2 diabetes who have already had a heart attack.
Lyn kinase activators
The LYN kinase activator tolimidone has been reported to potentiate insulin signaling in a manner that is distinct from the glitazones. The compound has demonstrated positive results in a Phase 2a clinical study involving 130 diabetic subjects.
Secretagogues
Secretagogues are drugs that increase output from a gland, in the case of insulin from the pancreas.
Sulfonylureas
Sulfonylureas were the first widely used oral anti-hyperglycemic medications. They are insulin secretagogues, triggering insulin release by inhibiting the KATP channel of the pancreatic beta cells. Eight types of these pills have been marketed in North America, but not all remain available. The "second-generation" drugs are now more commonly used. They are more effective than first-generation drugs and have fewer side-effects. All may cause weight gain.
Current clinical practice guidelines from the AACE rate sulfonylureas (as well as glinides) below all other classes of antidiabetic drugs in terms of suggested use as first, second, or third line agents - this includes bromocriptine, the bile acid sequestrant colesevelam, α-glucosidase inhibitors, TZDs (glitazones), and DPP-4 inhibitors (gliptins). The low cost of most sulfonylureas, however, especially when considering their significant efficacy in blood glucose reduction, tends to keep them as a more feasible option in many patients - neither SGLT2 inhibitors nor GLP-1 agonists, the classes most favored by the AACE guidelines after metformin, are currently available as generics.
Sulfonylureas bind strongly to plasma proteins. Sulfonylureas are useful only in type 2 diabetes, as they work by stimulating endogenous release of insulin. They work best with patients over 40 years old who have had diabetes mellitus for under ten years. They cannot be used with type 1 diabetes, or diabetes of pregnancy. They can be safely used with metformin or glitazones. The primary side-effect is hypoglycemia, which appears to happen more commonly with sulfonylureas than with other treatments.
A Cochrane systematic review from 2011 showed that treatment with Sulphonylurea did not improve control of glucose levels more than insulin at 3 nor 12 months of treatment. This same review actually found evidence that treatment with Sulphonylurea could lead to earlier insulin dependence, with 30% of cases requiring insulin at 2 years. When studies measured fasting C-peptide, no intervention influenced its concentration, but insulin maintained concentration better compared to Sulphonylurea. Still, it is important to highlight that the studies available to be included in this review presented considerable flaws in quality and design.
Typical reductions in glycated hemoglobin (A1C) values for second-generation sulfonylureas are 1.0–2.0%.
- First-generation agents
- Second-generation agents
- glipizide
- glyburide or glibenclamide
- glimepiride
- gliclazide
- glyclopyramide
- gliquidone
Meglitinides
Meglitinides help the pancreas produce insulin and are often called "short-acting secretagogues." They act on the same potassium channels as sulfonylureas, but at a different binding site. By closing the potassium channels of the pancreatic beta cells, they open the calcium channels, thereby enhancing insulin secretion.
They are taken with or shortly before meals to boost the insulin response to each meal. If a meal is skipped, the medication is also skipped.
Typical reductions in glycated hemoglobin (A1C) values are 0.5–1.0%.
Adverse reactions include weight gain and hypoglycemia.
Alpha-glucosidase inhibitors
Alpha-glucosidase inhibitors are "diabetes pills" but not technically hypoglycemic agents because they do not have a direct effect on insulin secretion or sensitivity. These agents slow the digestion of starch in the small intestine, so that glucose from the starch of a meal enters the bloodstream more slowly, and can be matched more effectively by an impaired insulin response or sensitivity. These agents are effective by themselves only in the earliest stages of impaired glucose tolerance, but can be helpful in combination with other agents in type 2 diabetes.
Typical reductions in glycated hemoglobin (A1C) values are 0.5–1.0%.
These medications are rarely used in the United States because of the severity of their side-effects (flatulence and bloating). They are more commonly prescribed in Europe. They do have the potential to cause weight loss by lowering the amount of sugar metabolized.
Injectable incretin mimetics
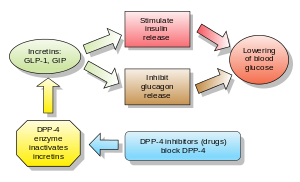
Incretins are also insulin secretagogues. The two main candidate molecules that fulfill criteria for being an incretin are glucagon-like peptide-1 (GLP-1) and gastric inhibitory peptide (glucose-dependent insulinotropic peptide, GIP). Both GLP-1 and GIP are rapidly inactivated by the enzyme dipeptidyl peptidase-4 (DPP-4).
Injectable glucagon-like peptide analogs and agonists
Glucagon-like peptide (GLP) agonists bind to a membrane GLP receptor. As a consequence, insulin release from the pancreatic beta cells is increased. Endogenous GLP has a half-life of only a few minutes, thus an analogue of GLP would not be practical. As of 2019, the AACE lists GLP-1 agonists, along with SGLT2 inhibitors, as the most preferred anti-diabetic agents after metformin. Liraglutide in particular may be considered first-line in diabetic patients with cardiovascular disease, as it has received FDA approval for reduction of risk of major adverse cardiovascular events in patients with type 2 diabetes. In a 2011 Cochrane review, GLP-1 agonists showed approximately a 1% reduction in HbA1c when compared to placebo. GLP-1 agonists also show improvement of beta-cell function, but this effect does not last after treatment is stopped. Due to shorter duration of studies, this review did not allow for long-term positiver or negative effects to be assessed.
- Exenatide (also Exendin-4, marketed as Byetta) is the first GLP-1 agonist approved for the treatment of type 2 diabetes. Exenatide is not an analogue of GLP but rather a GLP agonist. Exenatide has only 53% homology with GLP, which increases its resistance to degradation by DPP-4 and extends its half-life. A 2011 Cochrane review showed a HbA1c reduction of 0.20% more with Exenatide 2 mg compared to insulin glargine, exenatide 10 µg twice daily, sitagliptin and pioglitazone. Exenatide, together with liraglutide, led to greater weight loss than glucagon-like peptide analogues.
- Liraglutide, a once-daily human analogue (97% homology), has been developed by Novo Nordisk under the brand name Victoza. The product was approved by the European Medicines Agency (EMEA) on July 3, 2009, and by the U.S. Food and Drug Administration (FDA) on January 25, 2010. A 2011 Cochrane review showed a HbA1c reduction of 0.24% more with liraglutide 1.8 mg compared to insulin glargine, 0.33% more than exenatide 10 µg twice daily, sitagliptin and rosiglitazone. Liraglutide, together with exenatide, led to greater weight loss than glucagon-like peptide analogues.
- Taspoglutide is presently in Phase III clinical trials with Hoffman-La Roche.
- Lixisenatide (Lyxumia) Sanofi Aventis
- Semaglutide (Ozempic) (oral version is Rybelsus)
- Dulaglutide (Trulicity) - once weekly
- Albiglutide (Tanzeum) - once weekly
These agents may also cause a decrease in gastric motility, responsible for the common side-effect of nausea, which tends to subside with time.
Gastric inhibitory peptide analogs
Dipeptidyl peptidase-4 inhibitors
GLP-1 analogs resulted in weight loss and had more gastrointestinal side-effects, while in general dipeptidyl peptidase-4 (DPP-4) inhibitors were weight-neutral and increased risk for infection and headache, but both classes appear to present an alternative to other antidiabetic drugs. However, weight gain and/or hypoglycemia have been observed when dipeptidyl peptidase-4 inhibitors were used with sulfonylureas; effects on long-term health and morbidity rates are still unknown.
DPP-4 inhibitors increase blood concentration of the incretin GLP-1 by inhibiting its degradation by DPP-4.
Examples are:
- vildagliptin (Galvus) EU Approved 2008
- sitagliptin (Januvia) FDA approved Oct 2006
- saxagliptin (Onglyza) FDA Approved July 2009
- linagliptin (Tradjenta) FDA Approved May 2, 2011
- alogliptin
- septagliptin
- teneligliptin
- gemigliptin (Zemiglo)
DPP-4 inhibitors lowered hemoglobin A1C values by 0.74%, comparable to other antidiabetic drugs.
A result in one RCT comprising 206 patients aged 65 or older (mean baseline HgbA1c of 7.8%) receiving either 50 or 100 mg/d of sitagliptin was shown to reduce HbA1c by 0.7% (combined result of both doses). A combined result of 5 RCTs enlisting a total of 279 patients aged 65 or older (mean baseline HbA1c of 8%) receiving 5 mg/d of saxagliptin was shown to reduce HbA1c by 0.73%. A combined result of 5 RCTs enlisting a total of 238 patients aged 65 or older (mean baseline HbA1c of 8.6%) receiving 100 mg/d of vildagliptin was shown to reduce HbA1c by 1.2%. Another set of 6 combined RCTs involving alogliptin (approved by FDA in 2013) was shown to reduce HbA1c by 0.73% in 455 patients aged 65 or older who received 12.5 or 25 mg/d of the medication.
Injectable amylin analogues
Amylin agonist analogues slow gastric emptying and suppress glucagon. They have all the incretins actions except stimulation of insulin secretion. 2007年現在[update], pramlintide is the only clinically available amylin analogue. Like insulin, it is administered by subcutaneous injection. The most frequent and severe adverse effect of pramlintide is nausea, which occurs mostly at the beginning of treatment and gradually reduces. Typical reductions in A1C values are 0.5–1.0%.
SGLT2 inhibitors
SGLT2 inhibitors block the sodium-glucose linked transporter 2 proteins in renal tubules of nephrons in kidneys, reabsorption of glucose in into the renal tubules, promoting excretion of glucose in the urine. This causes both mild weight loss, and a mild reduction in blood sugar levels with little risk of hypoglycemia. Oral preparations may be available alone or in combination with other agents. Along with GLP-1 agonists, they are considered preferred second or third agents for type 2 diabetics sub-optimally controlled with metformin alone, according to most recent clinical practice guidelines. Because they are taken by mouth, rather than injected (like GLP-1 agonists), patients who are injection-averse may prefer these agents over the former. They may be considered first line in diabetic patients with cardiovascular disease, especially heart failure, as these medications have been shown to reduce the risk of hospitalization in patients with such comorbidities. Because they are not available as generic medications, however, cost may limit their feasibility for many patients. Furthermore, there has been growing evidence that the effectiveness and safety of this drug class could depend on genetic variability of the patients.
Examples include:
The side effects of SGLT2 inhibitors are derived directly from their mechanism of action; these include an increased risk of: ketoacidosis, urinary tract infections, candidal vulvovaginitis, and hypoglycemia.
Comparison
The following table compares some common anti-diabetic agents, generalizing classes, although there may be substantial variation in individual drugs of each class. When the table makes a comparison such as "lower risk" or "more convenient" the comparison is with the other drugs on the table.
| Comparison of anti-diabetic medication | ||||
|---|---|---|---|---|
| Drug class | Mechanism of action | Advantages | Disadvantages | |
| Sulfonylureas (glyburide, glimepiride, glipizide) | Stimulating insulin release by pancreatic beta cells by inhibiting the KATP channel |
|
| |
| Metformin | Acts on the liver to reduce gluconeogenesis and causes a decrease in insulin resistance via increasing AMPK signalling. |
|
| |
| Alpha-glucosidase inhibitors (acarbose, miglitol, voglibose) | Inhibit carbohydrate digestion in the small intestine by inhibiting enzymes that break down polysaccharides |
|
| |
| Thiazolidinediones (Pioglitazone, Rosiglitazone) | Reduce insulin resistance by activating PPAR-γ in fat and muscle |
|
| |
| SGLT2 inhibitors | ||||
Generic
Many anti-diabetes drugs are available as generics. These include:
- Sulfonylureas – glimepiride, glipizide, glyburide
- Biguanides – metformin
- Thiazolidinediones (Tzd) – pioglitazone, Actos generic
- Alpha-glucosidase inhibitors – Acarbose
- Meglitinides – nateglinide
- Combination of sulfonylureas plus metformin – known by generic names of the two drugs
No generics are available for dipeptidyl peptidase-4 inhibitors (Onglyza), the glifozins, the incretins and various combinations. Sitagliptin patent expired in July 2022, leading to launch of generic sitagliptin brands . This lowered the cost of therapy for type 2 diabetes using sitagliptin .
Alternative Medicine
The effect of Ayurvedic treatments has been researched, however due to methodological flaws of relevant studies and research, it has not been possible to draw conclusions regarding efficacy of these treatments and there is insufficient evidence to recommend them.
Further reading
- Lebovitz, Harold E. (2004). Therapy For Diabetes Mellitus and Related Disorders (4th ed.). Alexandria, VA: American Diabetes Association. ISBN 978-1-58040-187-6.
- Adams, Michael Ian; Holland, Norman Norwood (2003). Core Concepts in Pharmacology. Englewood Cliffs, NJ: Prentice Hall. ISBN 978-0-13-089329-1.
| この記事は、クリエイティブ・コモンズ・表示・継承ライセンス3.0のもとで公表されたウィキペディアの項目Diabetes medication/ja(2 February 2024編集記事参照)を素材として二次利用しています。 Lua error in Module:Itemnumber at line 91: attempt to concatenate local 'qid' (a nil value). |