インスリン
| INS | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifiers | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Aliases | IDDMIDDM1IDDM2ILPRIRDNMODY10insulinPNDM4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| External IDs | GeneCards: [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||

インスリン(Insulin、/ˈɪn.sjʊ.lɪn/、ラテン語の島に由来)は、ヒトにおいてインスリン(INS)によってコードされる膵島のβ細胞によって産生されるペプチドホルモンである。遺伝子によってコードされている。体内の主な|アナボリックホルモンと考えられている。血液から肝臓、脂肪、骨格筋細胞へのグルコースの吸収を促進することによって、炭水化物、脂肪、タンパク質の代謝を調節する。 これらの組織において、吸収されたグルコースは糖新生を介してグリコーゲンに変換されるか、または脂肪形成を介して脂肪(トリグリセリド)に変換する際に使用され、肝臓の場合は両方である。肝臓によるグルコースの生産と分泌は、血中の高濃度のインスリンによって強く阻害される。循環インスリンはまた、多種多様な組織におけるタンパク質の合成に影響を与える。したがって、同化ホルモンであり、血中の小分子の細胞内の大分子への変換を促進する。血中のインスリン濃度が低いと、広範な異化、特に予備軍体脂肪の代謝を促進することにより、逆の効果をもたらす。
β細胞は血糖値に敏感で、グルコースレベルが高いとインスリンを血液中に分泌し、グルコースレベルが低いとインスリンの分泌を抑制する。インスリン産生はグルコースによっても調節される:高グルコースではインスリン産生が促進され、低グルコースレベルでは産生が低下する。インスリンは細胞内でのグルコースの取り込みと代謝を促進し、血糖値を下げる。その隣のα細胞は、β細胞からの合図を受けて、血糖値が低いと分泌を増やし、グルコース濃度が高いと分泌を減らすという逆の方法で、血液中にグルカゴンを分泌する。グルカゴンは肝臓での糖新生とグリコーゲン分解を刺激することで血糖値を上昇させる。血中グルコース濃度に応じたインスリンとグルカゴンの血中への分泌は、グルコースホメオスタシスの主要なメカニズムである。
インスリンの活性が低下したり消失したりすると、血糖値が高い状態(高血糖)である糖尿病になる。この病気には2つのタイプがある。1型糖尿病では、自己免疫反応によってβ細胞が破壊され、インスリンが合成されなくなり、血液中に分泌されなくなる。2型糖尿病では、β細胞の破壊は1型ほど顕著ではなく、自己免疫過程によるものではない。その代わりに、膵島にアミロイドが蓄積し、その解剖学的・生理学的構造が破壊されると考えられる。2型糖尿病の発症機序はよくわかっていないが、膵島β細胞の個体数の減少、生存している膵島β細胞の分泌機能の低下、末梢組織のインスリン抵抗性が関与していることが知られている。2型糖尿病は、血糖値の影響を受けず、血糖値にも反応しないグルカゴン分泌の増加を特徴とする。しかし、インスリンは依然として血中グルコースに反応して血中に分泌される。その結果、血液中にグルコースが蓄積する。
ヒトのインスリンタンパク質は51個のアミノ酸から構成され、5808Daの分子量を持つ。A鎖とB鎖がジスルフィド結合で結合したヘテロダイマーである。インスリンの構造は動物の種間でわずかに異なる。ヒト以外の動物由来のインスリンは、これらの変異のため、ヒトのインスリンとは有効性(糖代謝効果)が多少異なる。特に豚のインスリンはヒトのものに近く、ヒトのインスリンが組換えDNA技術によって大量に生産できるようになる前は、1型糖尿病患者の治療に広く用いられていた。
インスリンは最初に発見されたペプチドホルモンである。フレデリック・バンティングとチャールズ・ベストは、トロント大学のジョン・マクラウドの研究室で研究し、1921年に犬の膵臓からインスリンを初めて単離した。フレデリック・サンガーは1951年にアミノ酸構造を決定し、インスリンは完全に配列が決定された最初のタンパク質となった。1969年にドロシー・ホジキンによって固体状態のインスリンの結晶構造が決定された。インスリンはまた、化学的に合成され、DNA組み換え技術によって生産された最初のタンパク質である。基本的な保健システムで必要とされる最も重要な医薬品であるWHO必須医薬品モデルリストに掲載されている。
進化と種の分布
インスリンは10億年以上前に誕生した可能性がある。インスリンの分子的起源は、少なくとも最も単純な単細胞真核生物まで遡る。動物以外では、インスリン様タンパク質は菌類や原生生物にも存在することが知られている。
インスリンは、ほとんどの脊椎動物では膵島のβ細胞によって、一部の硬骨魚ではブロックマン体によって産生される。円錐カタツムリ: コヌス・ジオグラファスとコヌス・チューリパは小魚を狩る毒を持つ巻き貝で、毒のカクテルにインスリンの改良型を使用している。このインスリン毒素は、カタツムリ本来のインスリンよりも魚類のインスリンに近い構造をしており、血糖値を下げることで獲物の魚の動きを鈍らせる。
生産

インスリンは、哺乳類では膵島のβ細胞、一部の魚類ではブロックマン体でのみ産生される。ヒトのインスリンは11番染色体上にあるINS遺伝子から産生される。1つはほとんどの哺乳類遺伝子のホモログ(Ins2)であり、もう1つはプロモーター配列を含むがイントロンを欠くレトロポーズドコピー(Ins1)である。インスリン遺伝子の転写は、血糖値の上昇に反応して増加する。これは主に、遺伝子の転写開始部位の約400塩基対前にあるエンハンサー配列に結合する転写因子によって制御されている。
インスリン分泌に影響を及ぼす主な転写因子は、PDX1、NeuroD1、MafAである。
低グルコース状態では、PDX1(膵・十二指腸ホメオボックスタンパク質1)は、HDAC1および2との相互作用の結果、核周辺に位置し、インスリン分泌のダウンレギュレーションをもたらす。血中グルコース濃度の上昇はPDX1のリン酸化を引き起こし、核内転移してインスリンプロモーター内のA3エレメントに結合する。核内移行したPDX1は、コアクチベーターHAT p300およびSETD7と相互作用する。PDX1は、メチル化だけでなく、アセチル化や脱アセチル化を通してヒストンの修飾に影響を与える。また、グルカゴンを抑制するとも言われている。
β2としても知られるNeuroD1は、エキソサイトーシスに関与する遺伝子の発現を直接誘導することで、膵臓のβ細胞におけるインスリンのエキソサイトーシスを制御している。β2は細胞質に局在しているが、高グルコースに応答するとOGTによって糖鎖化され、ERKによってリン酸化される。核内でβ2はE47とヘテロ二量体化し、インスリンプロモーターのE1エレメントに結合し、β2をアセチル化するコアクチベーターp300をリクルートする。インスリン遺伝子の活性化において、他の転写因子とも相互作用することができる。
MafAは血中グルコース濃度が低いとプロテアソームによって分解される。グルコース濃度が上昇すると、未知のタンパク質がグリコシル化される。このタンパク質は未知の方法でMafAの転写因子として働き、MafAは細胞外に輸送される。そしてMafAは再び核内に移動し、そこでインスリンプロモーターのC1エレメントに結合する。
これらの転写因子は相乗的かつ複雑な配置で働く。血中グルコースの増加は、しばらくするとこれらのタンパク質の結合能を破壊するため、分泌されるインスリンの量を減少させ、糖尿病を引き起こす。結合活性の低下は、グルコースによって誘導される酸化ストレスによって媒介される可能性があり、抗酸化物質は糖毒性膵臓β細胞におけるインスリン分泌の低下を防ぐと言われている。ストレスシグナル分子や活性酸素種は、転写因子を結合する補因子や転写因子そのものを阻害することにより、インスリン遺伝子を阻害する。
ヒトインスリン遺伝子のプロモーター領域にあるいくつかの制御配列は転写因子に結合する。 一般的に、A-boxはPdx1因子に、E-boxはNeuroDに、C-boxはMafAに、cAMP応答エレメントはCREBに結合する。転写を阻害するサイレンサーも存在する。
合成

インスリンは不活性な前駆体分子として合成され、「プレプロインスリン」と呼ばれる110アミノ酸長のタンパク質である。プレプロインスリンは粗面小胞体(RER)に直接翻訳され、そこでシグナルペプチドがシグナルペプチダーゼによって除去され、"プロインスリン "が形成される。プロインスリンが折り畳みされると、「A鎖」と「B鎖」と呼ばれるタンパク質の反対側の末端が3つのジスルフィド結合で融合される。折り畳まれたプロインスリンはゴルジ装置を通過し、特殊な分泌小胞にパッケージされる。顆粒では、プロインスリンはプロテイン転換酵素1/3とプロテイン転換酵素2によって切断され、「C-ペプチド」と呼ばれるタンパク質の中間部分が取り除かれる。最後に、カルボキシペプチダーゼEがタンパク質の末端から2対のアミノ酸を除去し、2つのジスルフィド結合でつながった活性型インスリンA鎖とインスリンB鎖ができる。
その結果、成熟したインスリンは成熟した顆粒内にパッケージされ、代謝シグナル(ロイシン、アルギニン、グルコース、マンノースなど)と迷走神経刺激を待って、細胞から循環中にエキソサイトーズされる。
インスリンとその関連タンパク質は脳内で生成されることが示されており、これらのタンパク質のレベル低下はアルツハイマー病と関連している。
インスリンの分泌は、β2受容体の刺激によっても促進され、α1受容体の刺激では抑制される。さらに、コルチゾール、グルカゴン、成長ホルモンはストレス時にインスリンの作用に拮抗する。インスリンはまた、脂肪組織におけるホルモン感受性リパーゼによる脂肪酸放出を阻害する。
構造
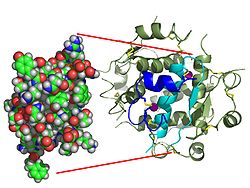
ホルモンは一般的に小さな化学分子であろうという当初の考えに反して、その構造が知られている最初のペプチドホルモンとして、インスリンは非常に大きいことが発見された。ヒトインスリンの単一のタンパク質(モノマー)は、51アミノ酸から構成され、5808Daの分子質量を有する。ヒトインスリンの分子式は、C257H383N65O77S6である。A鎖とB鎖という2本のペプチド鎖(ダイマー)が2つのジスルフィド結合によって結合したものである。A鎖は21個のアミノ酸からなり、B鎖は30個のアミノ酸からなる。連結(鎖間)ジスルフィド結合は、A7-B7位とA20-B19位の間のシステイン残基で形成される。A鎖内にはさらに(鎖内)ジスルフィド結合がA6位とA11位のシステイン残基間に存在する。A鎖は、A1-A8とA12-A19に2つのαヘリカル領域があり、これらは反平行である。一方、B鎖は、ジスルフィド結合に挟まれた中央のαヘリックス(残基B9-B19をカバー)と2つのβシート(B7-B10とB20-B23をカバー)を持つ。
インスリンのアミノ酸配列は強保存であり、種間でわずかに異なるだけである。ウシのインスリンは3つのアミノ酸残基のみ、ポルシンのインスリンは1つのアミノ酸残基のみヒトと異なる。ある種の魚のインスリンでさえ、ヒトに臨床的に有効であるほどヒトに似ている。いくつかの無脊椎動物のインスリンはヒトのインスリンと配列が非常に似ており、同様の生理学的効果を持つ。多様な種のインスリン配列に見られる強い相同性は、動物の進化の歴史の大部分にわたって保存されてきたことを示唆している。しかし、プロインスリンのC-ペプチドは、種によってかなり異なる。
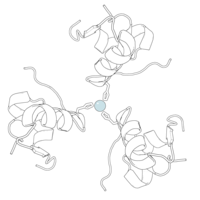
インスリンは6量体(インスリン分子6個の単位)として体内で生成・貯蔵されるが、活性型は単量体である。六量体の大きさは約36000Daである。6つの分子は3つの二量体として結合し、対称的な分子を形成する。重要な特徴は、対称軸上に亜鉛原子(Zn2+)が存在することで、この亜鉛原子は3つの水分子とB10位の3つのヒスチジン残基に囲まれている。
六量体は長期安定性を持つ不活性型であり、反応性の高いインスリンを保護しながらも容易に利用できるようにする役割を果たす。六量体-単量体変換は、注射用インスリン製剤の中心的な側面の一つである。しかし、拡散速度は粒子径に反比例するため、モノマーは反応速度の速い薬物である。即効性のある薬物は、インスリン注射を食事の時間より何時間も前にする必要がないことを意味し、その結果、糖尿病患者の毎日のスケジュールに柔軟性を与える。インスリンは凝集し、線維状のβシートを形成することがある。これは注射アミロイドーシスの原因となり、インスリンの長期保存を妨げる。
機能
分泌
ランゲルハンス島のベータ細胞は、2つのフェーズでインスリンを放出する。第一段階の放出は、血糖値の上昇に反応して急速に引き起こされ、約10分間持続する。第二相は、糖とは無関係に引き起こされる新しく形成された小胞の持続的なゆっくりとした放出で、2~3時間でピークに達する。インスリン放出の2つの段階は、インスリン顆粒が多様な発現集団または "プール"に存在することを示唆している。インスリンのエキソサイトーシスの第一段階では、エキソサイトーシスに適した顆粒のほとんどがカルシウムの内在化後に放出される。このプールはRRP(Readily Releasable Pool)として知られている。RRP顆粒は全インスリン含有顆粒集団の0.3-0.7%を占め、細胞膜に隣接して存在する。エキソサイトーシスの第二段階において、インスリン顆粒は細胞膜への顆粒の動員を必要とし、その放出を受けるには事前の準備が必要である。従って、インスリン放出の第二段階は、顆粒が放出の準備をする速度に支配される。このプールはリザーブプール(RP)として知られている。RPはRRPよりも放出速度が遅い(RRP:18顆粒/分、RP:6顆粒/分)。第一相インスリン放出の低下は、2型糖尿病の発症を予測する最も早期に検出可能なβ細胞の欠陥であるかもしれない。第一相分泌とインスリン感受性は糖尿病の独立した予測因子である。
第一相放出の説明は以下の通りである:
- グルコースはグルコーストランスポーターGLUT 2を介してβ細胞に入る。低血糖レベルではグルコースはほとんどβ細胞に入らないが、高血糖濃度では大量のグルコースがβ細胞に入る。
- β細胞に入ったグルコースはグルコキナーゼ(ヘキソキナーゼIV)によってグルコース-6-リン酸(G-6-P)にリン酸化される。つまり、細胞内のG-6-P濃度は血糖濃度に比例したままである。
- グルコース-6-リン酸は解糖経路に入り、次にピルビン酸デヒドロゲナーゼ反応を経てクレブスサイクルに入り、そこで複数の高エネルギーATP分子がアセチルCoA(クレブスサイクルの基質)の酸化によって産生され、細胞内のATP:ADP比の上昇をもたらす。
- 細胞内のATP:ADP比が増加すると、ATP感受性のSUR1/Kir6.2カリウムチャネル(スルホニルウレア受容体を参照)を閉じる。これにより、カリウムイオン(K+)が拡散促進によって細胞外に出ることができなくなり、細胞内にカリウムイオンが蓄積する。その結果、細胞内は外部に対して陰性化し、細胞表面膜の脱分極につながる。
- 脱分極すると、電位依存性カルシウムイオン(Ca2+)チャネルが開き、カルシウムイオンが拡散促進によって細胞内に移動する。
- 細胞質カルシウムイオン濃度は、リアノジン受容体の活性化による細胞内貯蔵カルシウムの放出によっても上昇する。
- β細胞の細胞質内のカルシウムイオン濃度は、細胞外のリガンド(ホルモンまたは神経伝達物質)とGタンパク質共役型膜受容体との結合によって生じるホスホリパーゼCの活性化によっても、あるいは追加的に上昇する。ホスホリパーゼCは膜リン脂質であるホスファチジルイノシトール4,5-ビスホスフェートをイノシトール1,4,5-トリスホスフェートとジアシルグリセロールに切断する。その後、イノシトール1,4,5-三リン酸(IP3)は小胞体(ER)の細胞膜にある受容体タンパク質に結合する。これにより、IP3ゲートチャネルを介してERからCa2+イオンが放出され、高血糖の影響とは無関係にカルシウムイオンの細胞質濃度が上昇する。膵島への副交感神経刺激は、この経路を介して作用し、血中へのインスリン分泌を増加させる。
- 細胞質内のカルシウムイオンの量が著しく増加すると、細胞内の分泌小胞に蓄えられていた、以前に合成されたインスリンが血液中に放出される。小胞に貯蔵されていた。
これがインスリン放出の主なメカニズムである。インスリン分泌を刺激する他の物質としては、アミノ酸のアルギニンやロイシン、副交感神経から放出されるアセチルコリン(ホスホリパーゼC経路を介して作用する)、スルホニル尿素などが知られている、 コレシストキニン(CCK、これもホスホリパーゼCを介して作用する)、グルカゴン様ペプチド-1(GLP-1)やグルコース依存性インスリントロピックペプチド(GIP)などの消化管由来のインクレチンなどがある。
インスリンの放出はノルエピネフリン(ノルアドレナリン)によって強く阻害されるため、ストレス時には血糖値が上昇する。 交感神経系によるカテコールアミンの放出は、β細胞によるインスリン放出に相反する影響を及ぼすようであるが、これはインスリン放出がα2-アドレナリン受容体によって阻害され、β2-アドレナリン受容体によって刺激されるからである。交感神経からのノルエピネフリンと副腎からのエピネフリンがインスリン放出に及ぼす正味の影響は、α-アドレナリン受容体の優位性による抑制である。
グルコースレベルが通常の生理的値まで下がると、β細胞からのインスリン放出は遅くなるか停止する。血糖値がこれより低下した場合、特に危険な低レベルまで低下した場合、高血糖ホルモン(最も顕著なのはランゲルハンス島α細胞からのグルカゴン)の放出により、肝臓のグリコーゲン貯蔵庫から血液中にグルコースが放出され、グリコーゲン貯蔵庫が枯渇した場合は糖新生により補充される。血中グルコースを増加させることにより、高血糖ホルモンは生命を脅かす低血糖を予防または改善する。
グルコース負荷(75gまたは100gのグルコース)摂取後30分で血糖値が大幅に上昇し、その後100分かけてゆっくりと下降し、試験開始後2時間経過しても120 mg/100mLを超えたままである。正常な人の場合、血糖値は検査終了時には補正されている(わずかに補正されすぎている場合もある)。インスリン・スパイクは、血糖値上昇に対する "最初の反応"であり、この反応は、以前は常に食品タイプにのみ特異的であると考えられていたが、個人および用量に特異的である。
振動

消化中であっても、一般的には食後1~2時間で、膵臓からのインスリン放出は連続的ではなく、3~6 分の周期で振動し、約100~800pmol以上の血中インスリン濃度が変化する。これは、標的細胞におけるインスリン受容体のダウンレギュレーションを回避し、肝臓が血中からインスリンを抽出するのを補助するためと考えられている。この振動は、インスリン刺激医薬品を投与する際に考慮すべき重要な点である。なぜなら、理想的には、一定の高濃度ではなく、インスリン放出の振動する血中濃度が達成されるべきであるからである。これは、門脈へのリズミカルにインスリンを送達する、光活性化送達、または肝臓への膵島細胞移植によって達成されるかもしれない。
血中インスリン濃度

血中インスリン濃度は、μIU/mLなどの国際単位またはpmol/Lなどのモル濃度で測定することができ、1μIU/mLは6.945pmol/Lに相当する。典型的な食間の血中濃度は8~11μIU/mL(57~79pmol/L)である。
シグナル伝達
インスリンの作用は、細胞膜に存在する受容体インスリン受容体(IR)との結合によって開始される。受容体分子はαサブユニットとβサブユニットを含んでいる。2つの分子は結合してホモ二量体として知られているものを形成する。インスリンは、細胞外側を向いているホモ二量体のαサブユニットに結合する。βサブユニットにはチロシンキナーゼ酵素活性があり、インスリンの結合によって活性化される。この活性はβサブユニットの自己リン酸化を引き起こし、続いてインスリン受容体基質(IRS)として知られる細胞内のタンパク質のリン酸化を引き起こす。IRSのリン酸化はシグナル伝達カスケードを活性化し、他のキナーゼやインスリンの細胞内作用を媒介する転写因子の活性化につながる。
筋肉と脂肪細胞の細胞膜にGLUT4グルコーストランスポーターが挿入され、肝臓と筋肉組織でグリコーゲンが合成され、肝臓、脂肪、乳腺組織でグルコースがトリグリセリドに変換されるカスケードは、IRS-1によってホスホイノシトール3キナーゼ(PI3K)が活性化されることによって起こる。この酵素は細胞膜のホスファチジルイノシトール4,5-ビスリン酸(PIP2)をホスファチジルイノシトール3,4,5-三リン酸(PIP3)に変換し、次にプロテインキナーゼB(PKB)を活性化すし、リン脂質に変換される。活性化されたPKBは、GLUT4を含むエンドソームと細胞膜との融合を促進し、細胞膜におけるGLUT4トランスポーターの増加をもたらす。PKBはまた、グリコーゲン合成酵素キナーゼ(GSK)をリン酸化し、それによってこの酵素を不活性化する。つまり、その基質であるグリコーゲン合成酵素(GS)はリン酸化されず、脱リン酸化されたままである。活性酵素であるグリコーゲン合成酵素(GS)は、グルコースからグリコーゲンを合成する際の律速段階を触媒する。同様の脱リン酸化は、トリグリセリドを生成しうる組織においてマロニル-CoAを介した脂肪の合成につながる解糖の速度を制御する酵素や、肝臓における糖新生の速度を制御する酵素にも影響する。これらの最終的な酵素の脱リン酸化の全体的な効果は、これらの反応を実行できる組織では、グルコースからのグリコーゲンと脂肪合成が刺激され、グリコーゲン分解と糖新生による肝臓でのグルコース生産が抑制されることである。脂肪組織によるトリグリセリドの遊離脂肪酸とグリセロールへの分解も阻害される。
インスリンとレセプターの結合から生じた細胞内シグナルが産生された後、シグナル伝達の終了が必要となる。 分解の項で後述するように、インスリンと結合した受容体のエンドサイトーシスと分解が、シグナル伝達を終了させる主なメカニズムである。さらに、様々なシグナル伝達経路のチロシン残基がチロシンホスファターゼによって脱リン酸化されることによっても、シグナル伝達経路は終了する。 セリン/スレオニンキナーゼもインスリンの活性を低下させることが知られている。
インスリン-インスリン受容体複合体の構造は、X線結晶構造解析の技術を用いて決定されている。
生理学的効果


インスリンの世界的なヒトの代謝レベルに対する作用は以下の通りである:
インスリンの細胞に対する作用(間接的、直接的)には以下のようなものがある:
- グルコースの取り込みを刺激する - インスリンは、細胞によるグルコースの取り込みを誘導することにより、血中グルコース濃度を低下させる。これは、インスリンが筋肉や脂肪組織の細胞膜にGLUT4トランスポーターを挿入させ、グルコースが細胞内に入るようにするためである。
- 脂肪合成が増加 - インスリンは脂肪細胞に血中グルコースを取り込ませ、それはトリグリセリドに変換される。
- 脂肪酸のエステル化の増加 - 脂肪組織に脂肪酸から中性脂肪(すなわちトリグリセリド)を作らせる。
- 脂肪分解の減少 - 脂肪細胞の脂質貯蔵の血中脂肪酸とグリセロールへの変換を強制的に減少させる;インスリンの減少はその逆を引き起こす。
- グルコースレベルが高い場合、インスリンはヘキソキナーゼ酵素の活性化によりグリコーゲンの生成を誘導する。ヘキソキナーゼ酵素はグルコースにリン酸基を付加するため、細胞外に出ることができない分子を生成する。同時にインスリンは、リン酸基を除去するグルコース-6-ホスファターゼ酵素を阻害する。この2つの酵素がグリコーゲンの形成の鍵となる。また、インスリンはグリコーゲン合成を担うホスホフルクトキナーゼとグリコーゲン合成酵素を活性化する。
- 糖新生およびグリコーゲン分解の減少-主に肝臓における非炭水化物基質からのグルコースの産生を減少させる(肝臓に到達した内因性インスリンの大部分は肝臓から出ることはない);インスリンの減少は肝臓による様々な基質からのグルコース産生を引き起こす。
- タンパク質分解の減少-タンパク質の分解を減少させる。
- オートファジーの減少 - 損傷した小器官の分解レベルの低下。食後レベルはオートファジーを完全に阻害する。
- アミノ酸取り込みの増加-細胞に循環しているアミノ酸を吸収させる。
- 動脈筋緊張 - 動脈壁筋を強制的に弛緩させ、特に細動脈の血流を増加させる。
- 胃の胃壁細胞による塩酸の分泌増加。
- カリウムの取り込みの増加 - グリコーゲン(非常にスポンジ状の "湿った"物質で、細胞内水分の含有量を増加させ、それに伴うK+イオンも増加させる)を合成する細胞に細胞外液からカリウムを吸収させる;インスリンの不足は吸収を阻害する。インスリンによる細胞内カリウム取り込みの増加は、血漿中のカリウム濃度を低下させる。 これはおそらく、骨格筋細胞表面へのNa+/K+-ATPaseのインスリン誘導性転座を介して起こる。
- 急性にインスリンが結合すると、プロテインホスファターゼ2A(PP2A)が活性化され、二機能性酵素フルクトースビスホスファターゼ-2(PFKB1)が脱リン酸化され、ホスホフルクトキナーゼ-2(PFK-2)の活性部位が活性化される。PFK-2はフルクトース2,6-ビスリン酸の産生を増加させる。フルクトース2,6-ビスリン酸はアロステリックにPFK-1を活性化し、糖新生よりも解糖を優先させる。解糖が増加すると、マロニル-CoAの生成が増加する。この分子は脂肪生成に振り向けられ、カルニチンパルミトイルトランスフェラーゼI(CPT1)をアロステリックに阻害する。カルニチンパルミトイルトランスフェラーゼIは、脂肪酸代謝のために脂肪酸をミトコンドリアの膜間腔に移動させるのに必要なミトコンドリア酵素である。
インスリンはまた、血管コンプライアンスや認知など、他の身体機能にも影響を及ぼす。インスリンがヒトの脳に入ると、学習と記憶を強化し、特に言語記憶に有益である。経鼻インスリン投与によって脳のインスリンシグナル伝達を増強すると、食物摂取に対する急性の体温調節および糖質調節反応も増強されることから、中枢神経のインスリンは人体の様々なホメオスタシスまたは調節プロセスの調整に寄与していることが示唆される。インスリンはまた、視床下部からのゴナドトロピン放出ホルモンを刺激する作用もあり、したがって生殖能力に有利である。
分解
インスリン分子がレセプターにドッキングし、その作用を発揮すると、細胞外環境に放出されるか、あるいは細胞内で分解される。インスリンクリアランスの2つの主要な部位は肝臓と腎臓である。インスリンはタンパク質-ジスルフィド還元酵素(グルタチオン)という酵素によって分解され、A鎖とB鎖の間のジスルフィド結合を壊す。肝臓は初回通過時にほとんどのインスリンを除去するが、腎臓は体循環中のインスリンのほとんどを除去する。分解には通常、インスリン受容体複合体のエンドサイトーシスが関与し、続いてインスリン分解酵素が作用する。β細胞によって内因性に産生されたインスリン分子は、最初に循環に放出されてから約1時間以内に分解されると推定されている(インスリン半減期~4-6 分)。
エンドカンナビノイド代謝の調節因子
インスリンはエンドカンナビノイド(EC)代謝の主要な調節因子であり、インスリン治療は細胞内ECを減少させることが示されている。ECである2-arachidonoylglycerol(2-AG)とアナンダミド(AEA)は、EC代謝酵素のインスリン感受性発現変化に対応している。インスリン抵抗性の脂肪細胞では、ECの合成の上昇とECの分解の減少に一致する形で、インスリン誘導酵素の発現パターンが障害されている。その結果、インスリン抵抗性脂肪細胞は、インスリン刺激に応答してEC代謝を調節し、細胞内EC濃度を減少させることができず、肥満インスリン抵抗性個体はEC濃度の上昇を示すことが示唆された。この調節不全は、過剰な内臓脂肪の蓄積と腹部脂肪組織からのアディポネクチン放出の減少を引き起こし、さらに肥満や2型糖尿病に関連するいくつかの心代謝リスク因子の発症につながる。
低血糖症
「低血糖」としても知られる低血糖症は、血糖が正常値以下まで低下することである。その結果、不器用、会話障害、錯乱、意識喪失、発作、または死亡を含む様々な症状が生じることがある。空腹感、発汗、震え、脱力感もみられることがある。
低血糖の最も一般的な原因は、インスリンやスルホニルウレアなどの糖尿病の治療に用いられる医薬品である。食事量がいつもより少なかったり、運動量がいつもより多かったり、アルコールを摂取したりした糖尿病患者では、リスクが高くなる。低血糖の他の原因としては、腎不全、特定の腫瘍、インスリノーマ、肝疾患、甲状腺機能低下症、飢餓、先天性代謝異常、重症感染症、反応性低血糖、アルコールを含む多くの薬物が挙げられる。低血糖は、数時間何も食べていない健康な赤ちゃんに起こることがある。
疾患と症候群
インスリン分泌障害が病態となる疾患はいくつかある:
- 糖尿病-高血糖を特徴とする全ての状態を指す総称である:
- 1型糖尿病 - 自己免疫を介して膵臓のインスリン産生β細胞が破壊され、インスリンが絶対的に欠乏する。
- 2型糖尿病 - β細胞によるインスリン分泌不全、あるいはインスリン抵抗性、あるいはその両方が起こる。
- 食事、座りがちなライフスタイル、肥満、加齢、メタボリックシンドロームとの相関がある。マウスやサルを含む複数のモデル生物で因果関係が証明されている。重要なことは、肥満でない人が2型糖尿病になるのは、食事、座りがちな生活、未知の危険因子が原因であるということであるが、これは因果関係ではない可能性があることに注意する必要がある。
- 環境条件によっては、遺伝的に2型糖尿病になりやすい可能性がある。
- その他の耐糖能障害(糖尿病を参照のこと)
- インスリノーマ - 過剰なインスリンまたは反応性低血糖を産生するβ細胞の腫瘍。
- メタボリックシンドローム - 最初にジェラルド・リーベンによってシンドロームXと呼ばれたよく理解されていない状態である。この症候群に単一の治療可能な原因があるのか、あるいは2型糖尿病につながる体の変化の結果なのかは明らかではない。この症候群は、血圧上昇、脂質異常症(血中コレステロールやその他の血中脂質の異常)、ウエスト周囲径の増大(少なくとも先進国の多くの集団において)を特徴とする。基本的な根本原因は、2型糖尿病に先行するインスリン抵抗性であり、これは一部の組織(例えば、筋肉、脂肪)におけるインスリン反応の能力の低下である。本態性高血圧、肥満、2型糖尿病、心血管系疾患(CVD)などの病的状態を発症するのが一般的である。
- 多嚢胞性卵巣症候群 - 生殖年齢にある女性の複合症候群で、無排卵とアンドロゲン過剰が一般的に多毛症として現れる。PCOSの多くの症例では、インスリン抵抗性が存在する。
医薬用途

臨床用の生合成ヒトインスリン(インスリンヒトrDNA、INN)は、組換えDNA技術によって製造される。生合成ヒトインスリンは、抽出動物インスリンと比較して純度が高く、純度の向上により抗体形成が抑制される。研究者らは、ベニバナでインスリンを生産するもう一つの方法("バイオファーミング")として、ヒトインスリンの遺伝子を植物に導入することに成功した。この技術により、生産コストの削減が期待される。
ヒトインスリンのいくつかのアナログが利用可能である。これらのインスリンアナログは、ヒトインスリン構造に密接に関連しており、速効性(プランディアルインスリン)と長時間作用(ベーサルインスリン)の観点から血糖コントロールの特定の側面のために開発された。最初の生合成インスリンアナログは、食事時に臨床使用するために開発されたヒューマログ(インスリンリスプロ)であり、通常のインスリンよりも皮下注射後の吸収が速く、注射後15 分で効果が現れる。他の速効型類似薬にはノボラピッドとアピドラがあり、プロファイルは似ている。いずれも、二量体や六量体の形成を抑えるアミノ酸配列により、速やかに吸収される(単量体のインスリンはより速やかに吸収される)。速効型インスリンは、ヒトのインスリンや動物のインスリンで以前推奨されていた注射から食事までの間隔を必要としない。もう1つのタイプは長時間作用型インスリンであり、これらの最初のものはランタス(インスリングラルギン)であった。これらは18時間から24時間という長時間にわたって安定した効果を発揮する。同様に、もう一つの持続型インスリンアナログ(レベミル)は脂肪酸アシル化のアプローチに基づいている。このアナログ製剤にはミリスチン酸分子が結合しており、インスリン分子を豊富な血清アルブミンに結合させる。速効型と遅効型は1日1回服用すればよく、1型糖尿病患者の基礎インスリンとして使用される。速効型インスリンと持効型インスリンの併用も可能であり、患者が体内のインスリン分泌を模倣したインスリンプロファイルを達成できる可能性が高くなる。インスリンはまた、モノクローナル抗体、ウイルスワクチン、遺伝子治療製品の製造のために、CHO-s、HEK 293、Sf9などの多くの細胞株で使用されている。
インスリンは通常皮下注射として、針付きの単回使用注射器、インスリンポンプ経由、または使い捨て針付きの反復使用インスリンペンによって摂取される。吸入インスリンも米国市場で入手可能である。
HMDのDispovan単回使用ペンニードルは、自己投与を容易にするインド初のインスリン・ペンニードルである。このペンニードルは、極薄の壁とマルチレベルのテーパーポイントが特徴で、痛みを最小限に抑え、シームレスな医薬品送達を確実にすることで、患者の快適さを優先している。この製品は、幅広い販売チャネルを通じて、国内の発展途上地域に手頃な価格のペンニードルを提供することを目指している。さらに、これらの針のユニバーサルデザインは、すべてのインスリンペンとの互換性を保証する。
多くの医薬品とは異なり、インスリンは口から摂取することができない。なぜなら、胃腸管に導入された他のほとんどすべてのタンパク質と同様に、断片に還元され、そこですべての活性が失われるからである。インスリンを消化管から保護し、経口または舌下投与できるようにする方法については、いくつかの研究がある。
2021年、世界保健機関はインスリンを必須医薬品モデルリストに追加した。
インスリンやその他の医薬品はすべて、イギリスの国々では国民保健サービスによって糖尿病患者に無料で提供されている。
研究の歴史
発見
1869年、膵臓の構造を顕微鏡で研究していたとき、ベルリンの医学生であったポール・ランゲルハンスは、膵臓の大部分に散在する、それまで気づかれていなかったいくつかの組織の塊を同定した。後にランゲルハンス島ととして知られる「小さな細胞の山」の機能は当初不明のままであったが、後にエドゥアール・ラゲスは消化において調節的な役割を果たす分泌物を産生する可能性を示唆した。ポール・ランゲルハンスの息子、アーチボルドもまた、この調節の役割を理解するのに貢献した。
1889年、医師オスカー・ミンコフスキーはヨーゼフ・フォン・メリングと共同で、健康な犬から膵臓を摘出し、消化における膵臓の役割をテストした。尿を検査すると糖が検出され、膵臓と糖尿病の関係が初めて確立された。1901年、アメリカの医師であり科学者であるユージン・リンゼイ・オピーによって、膵臓の役割をランゲルハンス島に分離したとき、もう一つの大きな一歩が踏み出された: 「膵臓の病変の結果として起こる糖尿病は、ランゲルハンス島の破壊によって引き起こされ、これらの小体の一部または全部が破壊された場合にのみ起こる」
その後20年間、研究者たちは膵島の分泌物を単離する試みを何度か行った。1906年、ジョージ・ルートヴィヒ・ズエルツァーは膵臓エキスによる犬の治療で部分的な成功を収めたが、彼は研究を続けることができなかった。1911年から1912年にかけて、シカゴ大学のE.L.スコットは水性膵臓エキスを試し、「糖尿のわずかな減少」を指摘したが、彼の研究の価値について彼のディレクターを納得させることができず、研究は中止された。イスラエル・クライナーは1915年にロックフェラー大学で同様の効果を実証したが、第一次世界大戦で彼の研究は中断され、復帰することはなかった。
1916年、ニコライ・パウレスクは水性の膵臓エキスを開発した。このエキスを糖尿病の犬に注射すると、血糖値を正常化する効果があった。彼は第一次世界大戦のために実験を中断せざるを得なかったが、1921年にブカレストで行った研究と糖尿病犬のテストについて4つの論文を書いた。同年末、彼は『食物同化における膵臓の役割に関する研究』を出版した。
"インスリン"という名前は、1916年にエドワード・アルバート・シャーペイ=シェーファーによって、グルコース代謝を制御するランゲルハンス膵島(ラテン語で膵島または島を意味するinsula)によって産生される仮説上の分子に対して造語された。シャーペイ=シェーファーが知らない間に、ジャン・ド・メイヤーは1909年に同じ分子に対して非常によく似た「insuline」という言葉を発表していた。
抽出と精製
1920年10月、カナダ人のフレデリック・バンティングは、ミンコフスキーがもともと研究していた消化分泌物が膵島分泌物を分解し、うまく抽出することが不可能になっていると結論づけた。外科医であったバンティングは、膵管の閉塞は膵臓の大部分を萎縮させるが、ランゲルハンス島は無傷であることを知っていた。彼は、膵臓の残りの部分がほとんどなくなってしまえば、膵島から比較的純粋なエキスを作ることができると考えた。彼は自分自身にメモをした: 「犬の膵管を結紮する。膵島を残して膵頭が退化するまで犬を生かしておく。膵島の内部分泌を分離し、糖鎖を除去する。」

1921年の春、バンティングはトロントを訪れ、トロント大学の生理学教授であるジョン・マクレオドに自分のアイデアを説明した。マクレオドは当初、バンティングには研究の素養がなく、最新の文献にも精通していなかったため懐疑的だったが、バンティングが自分のアイデアを試すための実験スペースを提供することに同意した。マクレオドはまた、その夏、バンティングの実験助手として2人の学部生を手配したが、バンティングが必要とした実験助手は1人だけだった。チャールズ・ベストとクラーク・ノーブルがコインを投げ、ベストが勝って最初のシフトに入った。これはノーブルにとって不運であった。バンティングは夏の間ずっとベストを研究室に残し、最終的にノーベル賞の賞金の半分と発見の功績をベストと分け合ったからである。1921年7月30日、バンティングとベストは、ダクトで縛った犬の膵島から抽出物(「イズレチン」)の単離に成功し、それを糖尿病の犬に注射した。
バンティングとベストは、1921年秋にトロントに戻ったマクレオドにその結果を発表したが、マクレオドは実験デザインの欠陥を指摘し、より多くの犬とより良い設備で実験を繰り返すよう提案した。彼はバンティングとベストをより良い研究室に移し、バンティングに研究費から給料を払い始めた。数週間後、第2ラウンドの実験も成功し、マクラウドはその11月にトロントで非公開で結果を発表するのを手伝った。犬をダクトタイイングし、インスリンを抽出するのに数週間待つという時間のかかる作業にネックになっていたバンティングは、まだ消化腺が発達していない子牛の胎児膵臓からインスリンを抽出することを思いついた。12月までに、彼らは成牛の膵臓からインスリンを抽出することにも成功した。マクレオドはインスリンの精製に集中するため、研究室での他のすべての研究を中止した。彼は生化学者ジェームス・コリップを招いてこの作業を手伝わせ、チームは1ヶ月以内に臨床試験の準備ができたと感じた。

1922年1月11日、トロント総合病院で瀕死の状態にあった14歳の糖尿病患者レナード・トンプソンに、初めてインスリンの注射が行われた。しかし、その抽出液があまりにも不純だったため、トンプソンはひどいアレルギー反応を起こし、それ以降の注射は中止された。その後12日間、コリップは昼夜を問わず牛膵臓エキスの改良に努めた。2回目の注射は1月23日に行われ、明らかな副作用を引き起こすことなく、糖尿病の典型的な糖尿を解消した。アメリカ人最初の患者は、アメリカ国務長官チャールズ・エバンス・ヒューズの娘であるエリザベス・ヒューズであった。 ジョン・ラルストン・ウィリアムズは、トロントからニューヨーク州ロチェスターにインスリンを輸入し、ヘブンスを治療した。
バンティングとベストはコリップを邪魔者扱いし、決してうまくはいかなかった。1922年の春にかけて、ベストは大量のインスリンをオンデマンドで抽出できるまでに技術を向上させることに成功したが、製剤は不純物のままであった。薬物会社Eli Lilly and Companyは、1921年の最初の発表から間もなくして援助を申し出ており、4月にはLillyの申し出を受けた。11月、Lillyの主任化学者であるジョージ・B・ウォルデンは#Isoelectric precipitation|等電点沈殿を発見し、高度に精製されたインスリンを大量に生産することができた。その後まもなく、インスリンは一般向けに販売されるようになった。
特許
1922年1月末、インスリンの「共同発見者」4人の間に緊張が高まり、コリップは一時、彼の精製プロセスを個別に特許にすると脅した。そこで、非商業的な公衆衛生機関コノート研究所の所長であるジョン・G・フィッツジェラルドが仲立ちに入った。その結果、1922年1月25日の合意では2つの重要な条件が定められた: 1)共同研究者たちは、コンノートとの最初の共同研究期間中、営利目的の製薬会社との間で特許を取らないことに同意する契約を結ぶこと、2)フィッツジェラルドと4人の共同研究者たちの間で最初に話し合いがなされない限り、研究方針の変更は許されないこと、である。これによって意見の対立を抑え、研究をコンノートの公的使命に結びつけることができた。
当初、マクロードとバンティングは、医療倫理上の理由から、インスリンの製法を特許化することに特に消極的であった。しかし、Eli Lilly and Companyがほのめかしていたように、民間の第三者が研究を乗っ取り独占してしまうのではないか、品質管理の能力がなければ安全な流通を保証することは難しいのではないかという懸念が残った。そのためにエドワード・カルヴィン・ケンドールは貴重な助言を与えた。彼は1914年にメイヨー・クリニックでサイロキシンを単離し,自分とメイヨー兄弟とミネソタ大学との間の取り決めによってその製法を特許化し,その特許を公立大学に譲渡した。4月12日、バンティング、ベスト、コリップ、マクラウド、フィッツジェラルドは連名でトロント大学の学長に手紙を送り、同大学の理事会に特許を譲渡することを目的とした同様の取り決めを提案した。その書簡では、
特許は、他者による特許の持ち出しを防ぐ以外のいかなる目的にも使用されることはないだろうと強調されていた。調製方法の詳細が公表されれば、誰でも自由にエキスを調製することができるが、誰も利益を得る独占権を確保することはできないだろう
トロント大学理事会への譲渡は1923年1月15日に完了し、1ドルという形だけの支払いが行われた。この取り決めは、1923年のThe World's Workで「医療倫理の一歩前進」として祝福された。また、2010年代には、ヘルスケアや薬物の値ごろ感の問題に関して、多くのメディアの注目を集めた。
イーライリリーが製造工程の一部を個別に特許化しようとしていることにさらなる懸念が生じたため、コンノートのアシスタントディレクター兼インスリン部門責任者であるロバート・デフリースは、パテントプール方針を確立した。
構造解析と合成
精製された動物由来のインスリンは、当初、実験や糖尿病患者に利用可能な唯一のタイプのインスリンであった。1926年にジョン・ジェイコブ・アベルが結晶化したものを初めて製造した。タンパク質の性質を示す証拠は、1924年にMichael Somogyi、Edward A. Doisy、Philip A. Shafferによって初めて示された。1935年にハンス・ジェンセンとアール・A・エバンス・ジュニアがアミノ酸のフェニルアラニンとプロリンを単離したときに完全に証明された。
インスリンのアミノ酸構造は1951年にFrederick Sangerによって初めて明らかにされ、最初の合成インスリンは1960年代半ばにピッツバーグ大学のPanayotis KatsoyannisとRWTHアーヘン大学のHelmut Zahnの研究室で同時に生産された。合成結晶ウシインスリンは、1965年に中国の研究者によって達成された。インスリンの完全な3次元構造は、1969年にドロシー・ホジキンの研究室でX線結晶学によって決定された。
ハンス・E・ウェーバーがプレプロインスリンを発見したのは、1974年にカリフォルニア大学ロサンゼルス校で研究員として働いていた時である。1973年から1974年にかけて、ウェーバーはメッセンジャーRNAの単離、精製、翻訳方法の技術を学んだ。インスリンをさらに研究するために、彼はロサンゼルスの食肉処理場から膵臓組織を入手し、その後UCLAで家畜から入手した。彼は膵島細胞から全メッセンジャーRNAを単離し、精製し、それをゼノブス・ラエビスの卵母細胞で翻訳し、抗インスリン抗体を用いて沈殿させた。翻訳された全タンパク質をSDSポリアクリルアミドゲル電気泳動とスクロース勾配で測定したところ、インスリンとプロインスリンに対応するピークが分離された。しかし、ウェーバーが驚いたことに、プロインスリンより大きな分子に対応する3番目のピークが分離された。何回か実験を繰り返した後、彼は一貫してプロインスリンの前にこの大きなピークがあることに注目し、これはプロインスリンの上流にあるより大きな前駆体分子に違いないと判断した。1975年5月、ニューヨークで開催されたアメリカ糖尿病学会で、ウェーバーは自分の研究について口頭発表を行い、そこで初めてこの前駆体分子を「プレプロインスリン」と命名した。この口頭発表の後、ウェーバーは、プロインスリンの特徴付けに貢献した研究者であるドナルド・スタイナーから、彼の論文と発見について議論するために夕食に招待された。 1年後の1976年4月、この分子は、ハンス・ウェーバーの研究と発見を参照しながら、スタイナーによってさらに特徴づけられ、配列が決定された。プレプロインスリンは、転写と翻訳の過程を研究するための重要な分子となった。
1978年、アーサー・リッグスと板倉敬一によって、シティ・オブ・ホープのベックマン研究所で、Genentechのハーバート・ボイヤーとの共同研究により、大腸菌を用いて最初の遺伝子操作による合成「ヒト」インスリンが生産された。Swanson、Boyer、Eli Lilly and Companyによって設立されたGenentechは、1982年にヒューマリンというブランド名で初めて市販された生合成ヒトインスリンを販売した。世界中で使用されているインスリンの大部分は、生合成組換え "ヒト "インスリンまたはその類似体である。最近、カナダの研究者グループによって、簡単に栽培できるベニバナ植物を用いた別の方法が、より安価なインスリンの生産に使われるようになった。
組換えインスリンは酵母(通常サッカロマイセス・セレビシエ)または大腸菌で産生される。酵母では、インスリンはKexIIエンドプロテアーゼ(PCI/PCIIの酵母ホモログ)部位でインスリンA鎖とC末端に切断されたインスリンB鎖を分離した一本鎖タンパク質として操作される。 化学的に合成されたC末端テールは、次に安価なプロテアーゼであるトリプシンを用いた逆プロテオリシスによってインスリンにグラフトされる。通常、C末端テールのリジンはプロテオリシスを防ぐために化学的保護基で保護されている。 モジュラー合成が容易であることと、その領域での修飾が比較的安全であることが、C末端が修飾された一般的なインスリンアナログ(例:リスプロ、アスパルト、グルリジン)の理由である。 Genentech synthesisやBruce Merrifieldによるような完全な化学合成は、主にインスリンB鎖の沈殿との競合により、2つのインスリン鎖の組み換え効率が低いため好ましくない。
ノーベル賞

1923年のノーベル賞委員会は、インスリンの実用的な抽出をトロント大学のチームに託し、フレデリック・バンティングとジョン・マクラウドの2人にノーベル賞を授与した。彼らはインスリンの発見によって1923年にノーベル生理学・医学賞を受賞した。バンティングはベストの名前が挙がっていないことに憤慨し、彼と賞を分かち合い、マクレオドはすぐにジェームズ・コリップと賞を分かち合った。インスリンの特許はトロント大学に1ドルで売却された。
インスリンに関する研究では、他に2つのノーベル賞が授与されている。1955年にインスリンの一次構造を決定したイギリスの分子生物学者フレデリック・サンガーは1958年にノーベル化学賞を受賞した。ロザリン・サスマン・ヤロウはインスリンのラジオイムノアッセイの開発で1977年のノーベル医学賞を受賞した。
いくつかのノーベル賞もインスリンと間接的な関係がある。悪性貧血に対する最初の効果的な治療法の開発で1934年のノーベル賞を共同受賞したジョージ・マイノットは糖尿病を患っていた。ウィリアム・キャッスルは、1921年のインスリンの発見がミノの生還に間に合ったことで、悪性貧血の治療法の発見にもつながったと観察した。ドロシー・ホジキンは、1964年に結晶学の開発でノーベル化学賞を受賞した。この技術は、1969年にインスリンの完全な分子構造を解読するために使用された。
論争

バンティング、ベスト、コリップ、マクロードが発表した研究は、ヒト患者に使用するのに適した精製インスリンエキスの調製を代表するものであった。パウレスクは治療の原理を発見したが、彼の生理食塩水抽出物はヒトに使用することはできなかった。イアン・マーレイはニコライ・パウレスクに対する「歴史的な誤り」を正すために特に積極的に活動した。マレーはスコットランドのグラスゴーにあるアンダーソン医科大学の生理学教授であり、グラスゴーを代表する病院の代謝疾患科の科長であり、英国糖尿病学会の副会長であり、国際糖尿病連合の創設メンバーであった。マレーはこう書いている:
トロントのチームが研究を開始した当時、すでに膵臓の抗糖尿病ホルモンの抽出に成功し、糖尿病犬の高血糖を抑える効果を証明していた著名なルーマニアの科学者であるパウレスクについては、十分な評価がなされていない。
1923年、ノーベル研究所の元所長であるアルネ・ティセリウスは、私信の中で、パウレスクも同様に受賞に値するという個人的な意見を述べた。
さらに読む
- Laws GM, Reaven A (1999). Insulin resistance : the metabolic syndrome X. Totowa, NJ: Humana Press. ISBN 978-0-89603-588-1.
- Leahy JL, Cefalu WT (22 March 2002). Insulin Therapy (1st ed.). New York: Marcel Dekker. ISBN 978-0-8247-0711-8.
- Kumar S, O'Rahilly S (14 January 2005). Insulin Resistance: Insulin Action and Its Disturbances in Disease. Chichester, England: Wiley. ISBN 978-0-470-85008-4.
- Ehrlich A, Schroeder CL (16 June 2000). Medical Terminology for Health Professions (4th ed.). Thomson Delmar Learning. ISBN 978-0-7668-1297-0.
- Draznin B, LeRoith D (September 1994). Molecular Biology of Diabetes: Autoimmunity and Genetics; Insulin Synthesis and Secretion. Totowa, New Jersey: Humana Press. ISBN 978-0-89603-286-6.
- Misbin RI (February 2022). INSULIN - History from an FDA Insider. Washington, DC: Politics and Prose Publishing. ISBN 978-1-62429-391-7. Archived from the original on 29 June 2022. Retrieved 29 June 2022.
- Famous Canadian Physicians: Sir Frederick Banting at Library and Archives Canada
- McKeage K, Goa KL (2001). "Insulin glargine: a review of its therapeutic use as a long-acting agent for the management of type 1 and 2 diabetes mellitus". Drugs. 61 (11): 1599–624. doi:10.2165/00003495-200161110-00007. PMID 11577797. S2CID 46972328.
- Vecchio I, Tornali C, Bragazzi NL, Martini M (2018). "The Discovery of Insulin: An Important Milestone in the History of Medicine". Frontiers in Endocrinology. 9: 613. doi:10.3389/fendo.2018.00613. PMC 6205949. PMID 30405529.
外部リンク
- University of Toronto Libraries Collection: Discovery and Early Development of Insulin, 1920–1925
- CBC Digital Archives – Banting, Best, Macleod, Collip: Chasing a Cure for Diabetes
- Animations of insulin's action in the body at AboutKidsHealth.ca (archived 9 March 2011)
- Overview of all the structural information available in the PDB for UniProt: P01308 (Insulin) at the PDBe-KB.























![1jco: Solution structure of the monomeric [Thr(B27)->Pro,Pro(B28)->Thr] insulin mutant (PT insulin)](https://upload.wikimedia.org/wikipedia/commons/thumb/9/9a/PDB_1jco_EBI.jpg/180px-PDB_1jco_EBI.jpg)

![1mhj: SOLUTION STRUCTURE OF THE SUPERACTIVE MONOMERIC DES-[PHE(B25)] HUMAN INSULIN MUTANT. ELUCIDATION OF THE STRUCTURAL BASIS FOR THE MONOMERIZATION OF THE DES-[PHE(B25)] INSULIN AND THE DIMERIZATION OF NATIVE INSULIN](https://upload.wikimedia.org/wikipedia/commons/thumb/e/e8/PDB_1mhj_EBI.jpg/180px-PDB_1mhj_EBI.jpg)