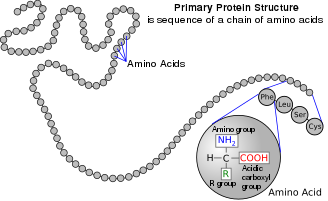
アミノ酸

アミノ酸は、アミノ基とカルボン酸基官能基の両方を含む有機化合物である。自然界には500種類以上のアミノ酸が存在するが、タンパク質に組み込まれる22種類のα-アミノ酸が圧倒的に重要である。生命の遺伝コードに登場するのはこの22種類だけである。
アミノ酸は、核となる構造官能基の位置によって分類することができる(α- (α-)、β- (β-)、γ- (γ-)アミノ酸など)。他のカテゴリは、極性(polarity)、イオン化、および側鎖基のタイプ(脂肪族、非環式、芳香族、極性(polar)など。 タンパク質の形態において、アミノ酸残基は人間の筋肉や他の組織の2番目に大きな成分(水が最も大きい)となっている。 タンパク質の残基としての役割を超えて、アミノ酸は神経伝達物質の輸送や生合成などの多くのプロセスに関与している。アミノ酸は地球上の生命とその出現において重要な役割を果たしたと考えられている。
アミノ酸は、IUPAC-IUBMBによって正式に命名されている。生化学命名法に関する合同委員会では、図のような架空の「中性」構造を用いて命名している。例えば、アラニンの系統名はCH
3−CH(NH
2)−COOH式に基づく2-アミノプロパン酸である。欧州委員会はこのアプローチを次のように正当化している:
ここで示した系統名と式は、アミノ基が非プロトン化され、カルボキシル基が解離されていない仮想的な形を指している。この慣例は様々な命名上の問題を避けるために有用であるが、これらの構造がアミノ酸分子のかなりの部分を表していることを意味するものではない。
歴史
最初のアミノ酸は1800年代初頭に発見された。1806年、フランスの化学者Louis-Nicolas VauquelinとPierre Jean Robiquetはアスパラガスから化合物を単離し、その後発見された最初のアミノ酸であるアスパラギンと命名された。シスチンは1810年に発見されたが、その単量体であるシステインは1884年まで発見されなかった。グリシンとロイシンは1820年に発見された。発見された20種類の一般的なアミノ酸の最後は、1935年にウィリアム・カミング・ローズによってスレオニンであり、彼はまた必須アミノ酸を決定し、最適な成長のためのすべてのアミノ酸の1日の最低必要量を確立した。
化学的カテゴリーの単一性は1865年にWurtzによって認識されたが、彼はそれに特別な名前を付けなかった。英語で「アミノ酸」という用語が初めて使われたのは1898年のことで、ドイツ語ではそれ以前にAminosäureという用語が使われていた。タンパク質は酵素消化または酸加水分解後にアミノ酸を生成することが発見された。1902年、Emil FischerとFranz Hofmeisterは、タンパク質は多数のアミノ酸から形成され、それによってあるアミノ酸のアミノ基と別のアミノ酸のカルボキシル基との間に結合が形成され、Fischerが「peptideペプチド」と呼んだ直鎖構造になることを独自に提唱した。
一般的な構造
2-、α-、またはα-アミノ酸は一般的な式H
2NCHRCOOHを持つ。ここでRは"側鎖"として知られる有機置換基である。
何百種類もあるアミノ酸のうち、22種類がタンパク原性(「タンパク質を作る」)である。これらの22種類の化合物が組み合わさって、リボソームによって組み立てられる膨大な数のペプチドやタンパク質ができる。非タンパク質原性アミノ酸あるいは修飾アミノ酸は、翻訳後修飾から、あるいは非リボソームペプチド合成中に生じる。
キラリティ
カルボキシル基の隣の炭素原子はα-炭素と呼ばれる。タンパク質原性アミノ酸では、各アミノ酸に固有のアミンとR基または側鎖を持つ。4つの異なる置換基を持つα-炭素は、グリシンを除くすべてのα-アミノ酸において立体異性である。すべての不斉タンパク質アミノ酸はL配置を持つ。これらは「左巻き」のエナンチオマーであり、α炭素の立体異性体を指す。
いくつかのD-アミノ酸(「右巻き」)は自然界で発見されており、例えばバクテリアのエンベロープの中、ニューロモジュレーター(D-セリン)、いくつかの抗生物質の中に含まれている。まれに、D-アミノ酸残基がタンパク質中に見られ、翻訳後修飾としてL-アミノ酸から変換される。
側鎖
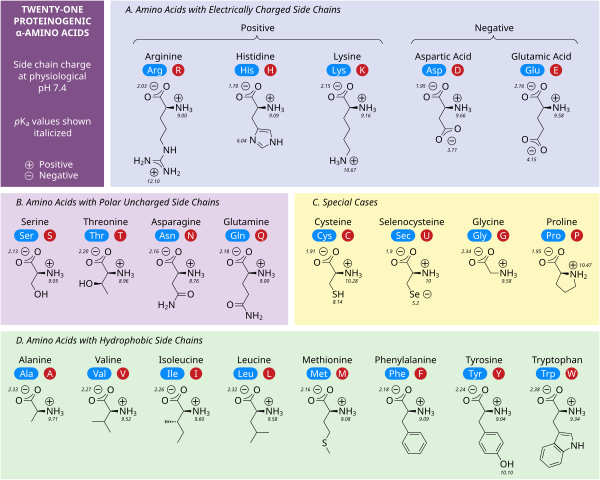
極性荷電側鎖
5つのアミノ酸は中性pHで電荷を持つ。多くの場合、これらの側鎖はタンパク質の表面に現れ、水への溶解を可能にする。反対の電荷を持つ側鎖は、塩橋と呼ばれる重要な静電的接触を形成し、1つのタンパク質内または相互作用するタンパク質間の構造を維持する。多くのタンパク質は金属を特異的にその構造に結合させ、これらの相互作用は一般的にアスパラギン酸、グルタミン酸、ヒスチジンなどの荷電側鎖によって媒介される。特定の条件下では、それぞれのイオン形成基が帯電し、二重塩を形成することがある。
中性pHで負に帯電した2つのアミノ酸は、アスパラギン酸(Asp、D)とグルタミン酸(Glu、E)である。アニオン性カルボキシレート基は、ほとんどの状況でブレンステッド塩基として振る舞う。哺乳類の胃に存在するアスパラギン酸プロテアーゼペプシンのように、非常に低いpH環境にある酵素は、ブレンステッド酸として働くアスパラギン酸残基やグルタミン酸残基を触媒として持つことがある。

アルギニン(Arg、R)、リジン(Lys、K)、ヒスチジン(His、H)の3つである。アルギニンは荷電したグアニジン基を持ち、リジンは荷電したアルキルアミノ基を持ち、pH7で完全にプロトン化される。ヒスチジンのイミダゾール基はpKaが6.0であり、中性pHでは10%程度しかプロトン化されない。ヒスチジンは塩基性と共役酸の形で容易に見出されるため、酵素反応における触媒的プロトン移動にしばしば関与する。
極性荷電側鎖
セリン(Ser, S)、スレオニン(Thr, T)、アスパラギン(Asn, N)、グルタミン(Gln, Q)は、水や他のアミノ酸と容易に水素結合を形成する。通常の状態ではイオン化しないが、セリンプロテアーゼの触媒セリンは例外である。これは深刻な摂動の例であり、一般的なセリン残基の特徴ではない。スレオニンには2つの不斉中心があり、アキラルなグリシンを除くすべてのアミノ酸に共通するα-炭素のL(2S)不斉中心だけでなく、β-炭素の(3R)不斉中心もある。完全な立体化学的仕様は(2S,3R)-L-スレオニンである。
疎水性側鎖
非極性アミノ酸の相互作用は、折りたたみタンパク質が機能的な三次元構造になる過程の主要な原動力である。これらのアミノ酸の側鎖はいずれも容易にイオン化しないため、チロシン(Tyr、Y)を除いてpKaを持たない。チロシンの水酸基は高いpHで脱プロトン化し、負に帯電したフェノラートを形成する。このため、チロシンを極性、非荷電アミノ酸のカテゴリーに入れることもできるが、水への溶解度が非常に低いため、疎水性アミノ酸の特徴とよく一致する。
特別な場合の側鎖
いくつかの側鎖は、荷電性、極性、疎水性のカテゴリーではうまく説明できない。グリシン(Gly, G)は、そのサイズが小さいため、アミノ基とカルボキシレート基によって溶解度が大きく左右されることから、極性アミノ酸と考えられる。しかし、グリシンには側鎖がないため、アミノ酸の中でも独特の柔軟性があり、タンパク質のフォールディングに大きな影響を与える。システイン(Cys, C)も水素結合を形成しやすく、極性アミノ酸のカテゴリーに入るが、タンパク質構造中ではしばしば他のシステインとジスルフィド結合と呼ばれる共有結合を形成している。これらの結合はタンパク質の折り畳みと安定性に影響を与え、抗体の形成に不可欠である。プロリン(Pro, P)はアルキル側鎖を持ち、疎水性であると考えられるが、側鎖がαアミノ基に結合しているため、タンパク質に取り込まれると特に柔軟性がなくなる。グリシンと同様に、これはアミノ酸の中でもユニークな方法でタンパク質の構造に影響を与える。セレノシステイン(Sec, U)はDNAに直接コードされていないが、リボソームを介してタンパク質に組み込まれる珍しいアミノ酸である。セレノシステインは同様のシステインに比べて酸化還元電位が低く、いくつかのユニークな酵素反応に関与している。ピロリジン(Pyl, O)はDNAにコードされていない別のアミノ酸であるが、リボソームによってタンパク質に合成される。古細菌種に存在し、いくつかのメチルトランスフェラーゼの触媒活性に関与している。
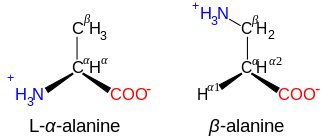
β-アミノ酸とγ-アミノ酸
カルノシンや他のいくつかのペプチドの成分であるβ-アラニンなど、構造NH+
3−CXY−CXY−CO−
2を持つアミノ酸はβ-アミノ酸である。構造NH+
3−CXY−CXY−CXY−CO−
2を持つものはγ-アミノ酸であり、XとYは2つの置換基(一方は通常H)である。
双性イオン

アミノ酸の一般的な天然型は、−NH+
3(プロリンの場合は−NH+
2−)と−CO−
2官能基が同じC原子に結合した双性イオン構造を持つ。リボソームで翻訳される過程でタンパク質中に発見される唯一のものである。
中性に近いpHの水溶液中では、アミノ酸は双性イオン、すなわちNH+
3とCO−
2の両方が荷電状態にある双極子イオンとして存在するため、全体の構造はNH+
3−CHR−CO−
2.となる。生理的pHでは、いわゆる「中性型」−NH
2−CHR−CO
2Hは測定可能な程度では存在しない。双性イオン構造における2つの電荷はゼロに加算されるが、正味電荷がゼロの種を「荷電していない」と呼ぶのは誤解を招く。
強酸性条件下(pH3以下)では、カルボン酸基がプロトン化され、構造はアンモニオカルボン酸NH+
3−CHR−CO
2Hとなる。これは、哺乳類の胃やリソソームなどの酸性環境で活性を発揮するペプシンのような酵素には関係するが、細胞内酵素にはあまり当てはまらない。高塩基性条件下(pH10以上、生理的条件下では通常見られない)では、アンモニオ基は脱プロトン化されてNH
2−CHR−CO−
2を与える。
酸や塩基の定義は、化学の世界では様々なものが使われているが、水溶液中の化学に有用なのは、ブレンステッドの理論だけである:酸とは、他の種にプロトンを供与できる種であり、塩基とは、プロトンを受容できる種である。この基準を用いて、上の図では基を表示している。アスパラギン酸残基とグルタミン酸残基のカルボン酸側鎖は、タンパク質中の主要なブレンステッド塩基である。同様に、リジン、チロシン、システインは通常ブレンステッド酸として働く。これらの条件下では、ヒスチジンはブレンステッド酸としても塩基としても働く。
等電点

荷電していない側鎖を持つアミノ酸の場合、2つのpKa値の間のpH値では双性イオンが優勢であるが、少量の正負イオンと平衡で共存する。2つのpKa値の中間点では、微量の正負イオンと微量の正イオンが釣り合い、存在するすべての形態の平均正電荷はゼロになる。このpHは等電点pIと呼ばれ、pI=1/2(pKa1 + pKa2)となる。
荷電側鎖を持つアミノ酸の場合、側鎖のpKaが関与する。したがって、負の側鎖を持つアスパラギン酸やグルタミン酸の場合、末端アミノ基は基本的に完全に荷電形−NH+
3であるが、この正の電荷は、ただ1つのC末端カルボキシレート基が負に荷電している状態と釣り合う必要がある。これは2つのカルボキシレートpKa値の中間で起こる:pI=1/2(pKa1 + pKa(R))、ここでpKa(R)は側鎖pKaである。
グルタミン酸(アスパラギン酸に似ている)だけでなく、システイン、ヒスチジン、リジン、チロシン、アルギニンなど、イオン化可能な側鎖を持つ他のアミノ酸にも同様の考察が当てはまる。
アミノ酸は電気泳動において等電点での移動度がゼロであるが、この挙動は単一アミノ酸よりもペプチドやタンパク質の方が通常利用される。双性イオンは等電点での溶解度が最小であり、一部のアミノ酸(特に非極性側鎖を持つもの)はpHを必要な等電点に調整することで水から沈殿させて単離することができる。
物理化学的性質
20種類のアミノ酸は、その性質によって分類することができる。重要な要素は、電荷、親水性または疎水性、サイズ、および官能基である。これらの特性はタンパク質構造やタンパク質間相互作用に影響を与える。水溶性タンパク質は疎水性残基(Leu、Ile、Val、Phe、Trp)がタンパク質の中央部に埋もれ、親水性側鎖が水溶媒に露出する傾向がある。生化学では、残基は多糖、タンパク質、核酸のポリマー鎖内の特定のモノマーを指す)。積分膜タンパク質は、脂質二重層に固定するために、露出した疎水性アミノ酸の外側の環を持つ傾向がある。一部の周辺膜タンパク質は表面に疎水性アミノ酸のパッチを持ち、それが膜に付着している。同様に、正電荷を帯びた分子と結合しなければならないタンパク質は、グルタミン酸やアスパラギン酸のような負電荷を帯びたアミノ酸を表面に多く持ち、負電荷を帯びた分子と結合するタンパク質は、リジンやアルギニンのような正電荷を帯びたアミノ酸を表面に多く持つ。例えば、リジンとアルギニンは核酸結合タンパク質のタンパク質の低複雑性領域に大量に存在する。アミノ酸残基の疎水性スケールには様々なものがある。
アミノ酸の中には特殊な性質を持つものがある。システインは他のシステイン残基と共有結合ジスルフィド結合を形成することができる。プロリンはポリペプチド骨格に環状を形成し、グリシンは他のアミノ酸よりも柔軟である。
一方、システイン、フェニルアラニン、トリプトファン、メチオニン、バリン、ロイシン、イソロイシンは、反応性が高く、複雑で、疎水性である。
多くのタンパク質は様々な翻訳後修飾を受け、それによってアミノ酸残基の側鎖に追加の化学基が付加され、時にはリポタンパク質(疎水性)や糖タンパク質(親水性)を生成し、タンパク質が膜に一時的に付着できるようになる。例えば、シグナル伝達タンパク質は、脂肪酸パルミチン酸を付加し、その後除去することができるシステイン残基を含むため、細胞膜に付着し、その後剥離することができる。
標準的なアミノ酸の略語と性質の表
表には1文字記号が含まれているが、IUPAC-IUBMBは「1文字記号の使用は長い配列の比較に限定すべきである」と勧告している。
1文字表記は、IUPAC-IUBが以下の規則に基づいて選択した:
- 曖昧さがない場合は頭文字を用いる: Cシステイン、Hヒスチジン、Iイソロイシン、Mメチオニン、Sセリン、Vバリン、
- 任意の割り当てが必要な場合は、構造的に単純なアミノ酸を優先する: A アラニン、G グリシン、L ロイシン、P プロリン、T スレオニン、
- FPHエニルアラニンとR aRジニンは、音韻的に暗示的であることによって割り当てられる、
- Wトリプトファンは、二重環がかさばる文字Wを視覚的に示唆することに基づいて割り当てられる、
- KリジンとYチロシンは、頭文字のLとTに最も近いアルファベットとして割り当てられた(UはVとの類似性から避けられ、Xは未定または非定型のアミノ酸のために確保されたことに注意);チロシンについては、tYrosineというニーモニックも提案された、
- Dアスパラギン酸は任意に割り当てられ、asparDic acidというニーモニックが提案された。Eグルタミン酸はアルファベット順に割り当てられ、1つのメチレン-CH2-基だけ大きくなった、
- Nアスパラギンは任意に割り当てられ、asparagiNeというニーモニックが提案された。Qグルタミンは、まだ利用可能なもののアルファベット順に割り当てられ(Dとの類似性のためにOが避けられたことに再度注意)、Qlutamineというニーモニックが提案された。
| アミノ酸 | 3 と 1文字記号 | 側鎖 | ハイドロパシー i指数 |
Molar absorptivity/ja | Molecular mass/ja | タンパク質中の 存在量 (%) |
標準的な遺伝子コーディング、 IUPAC表記法 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 1 | クラス | Chemical polarity/ja | pH 7.4での 正味電荷 |
波長, λ最大 (nm) |
係数 ε (mM−1·cm−1) | |||||
| Alanine/ja | Ala | A | 脂肪族 | 無極性 | ニュートラル | 1.8 | 89.094 | 8.76 | GCN | ||
| Arginine/ja | Arg | R | 固定陽イオン | 基本極性 | ポジティブ | −4.5 | 174.203 | 5.78 | MGR, CGY | ||
| Asparagine/ja | Asn | N | アミド | 極性 | ニュートラル | −3.5 | 132.119 | 3.93 | AAY | ||
| Aspartate/ja | Asp | D | 陰イオン | ブレンステッド塩基 | ネガティブ | −3.5 | 133.104 | 5.49 | GAY | ||
| Cysteine/ja | Cys | C | チオール | ブレンステッド塩基 | ニュートラル | 2.5 | 250 | 0.3 | 121.154 | 1.38 | UGY |
| Glutamine/ja | Gln | Q | アミド | 極性 | ニュートラル | −3.5 | 146.146 | 3.9 | CAR | ||
| Glutamate/ja | Glu | E | 陰イオン | ブレンステッド塩基 | ネガティブ | −3.5 | 147.131 | 6.32 | GAR | ||
| Glycine/ja | Gly | G | 脂肪族 | 無極性 | ニュートラル | −0.4 | 75.067 | 7.03 | GGN | ||
| Histidine/ja | His | H | 陽イオン性 | ブレンステッド酸と塩基 | ポジティブ, 10% ニュートラル, 90% |
−3.2 | 211 | 5.9 | 155.156 | 2.26 | CAY |
| Isoleucine/ja | Ile | I | 脂肪族 | 無極性 | ニュートラル | 4.5 | 131.175 | 5.49 | AUH | ||
| Leucine/ja | Leu | L | 脂肪族 | 無極性 | ニュートラル | 3.8 | 131.175 | 9.68 | YUR, CUY | ||
| Lysine/ja | Lys | K | 陽イオン | ブレンステッド酸 | ポジティブ | −3.9 | 146.189 | 5.19 | AAR | ||
| Methionine/ja | Met | M | チオエーテル | 無極性 | ニュートラル | 1.9 | 149.208 | 2.32 | AUG | ||
| Phenylalanine/ja | Phe | F | 芳香族 | 無極性 | ニュートラル | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165.192 | 3.87 | UUY |
| Proline/ja | Pro | P | 環状 | 無極性 | ニュートラル | −1.6 | 115.132 | 5.02 | CCN | ||
| Serine/ja | Ser | S | ヒドロキシル | 極性 | ニュートラル | −0.8 | 105.093 | 7.14 | UCN, AGY | ||
| Threonine/ja | Thr | T | ヒドロキシル | 極性 | ニュートラル | −0.7 | 119.119 | 5.53 | ACN | ||
| Tryptophan/ja | Trp | W | 芳香族 | 無極性 | ニュートラル | −0.9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | UGG |
| Tyrosine/ja | Tyr | Y | 芳香族 | ブレンステッド酸 | ニュートラル | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181.191 | 2.91 | UAY |
| Valine/ja | Val | V | 脂肪族 | 無極性 | ニュートラル | 4.2 | 117.148 | 6.73 | GUN | ||
通常ストップコドンと解釈されるコドンによって、さらに2つのアミノ酸がコードされている種もある:
| 21番目と22番目のアミノ酸 | 3文字 | 1文字 | Molecular mass/ja |
|---|---|---|---|
| Selenocysteine/ja | Sec | U | 168.064 |
| Pyrrolysine/ja | Pyl | O | 255.313 |
特定のアミノ酸コードに加えて、プレースホルダーは、ペプチドやタンパク質の化学的または結晶学的解析で残基の同一性を決定できない場合に使用される。また、保存タンパク質配列モチーフを要約するためにも使われる。類似した残基の集合を示すために単一の文字を使用することは、縮退塩基の略号コードの使用と似ている。
| あいまいなアミノ酸 | 3文字 | 1文字 | 含まれるアミノ酸 | 含まれるコドン |
|---|---|---|---|---|
| いずれか/不明 | Xaa | X | All | NNN |
| Asparagine/jaあるいはaspartate/ja | Asx | B | D, N | RAY |
| Glutamine/jaあるいはglutamate/ja | Glx | Z | E, Q | SAR |
| Leucine/jaあるいはイソロイシン | Xle | J | I, L | YTR, ATH, CTY |
| Hydrophobic/ja | Φ | V, I, L, F, W, Y, M | NTN, TAY, TGG | |
| Aromatic/ja | Ω | F, W, Y, H | YWY, TTY, TGG | |
| Aliphatic/ja (非芳香族) | Ψ | V, I, L, M | VTN, TTR | |
| Small | π | P, G, A, S | BCN, RGY, GGR | |
| Hydrophilic/ja | ζ | S, T, H, N, Q, E, D, K, R | VAN, WCN, CGN, AGY | |
| 正電化 | + | K, R, H | ARR, CRY, CGR | |
| 負電荷 | − | D, E | GAN |
Xaaの代わりにUnkが使われることもあるが、標準的ではない。
Terまたは*(terminationから)は、停止コドンが発生した場合のタンパク質の変異の表記に使われる。これはアミノ酸が全くないことに相当する。
さらに、多くの非標準アミノ酸は特定のコードを持っている。例えば、ボルテゾミブやMG132などのいくつかのペプチド薬物は、人工合成され、特定のコードを持つ保護基を保持している。ボルテゾミブはPyz-Phe-boroLeuであり、MG132はZ-Leu-Leu-Leu-alである。タンパク質の構造解析を助けるために、光反応性アミノ酸アナログが利用できる。これらには光ロイシン(pLeu)や光メチオニン(pMet)が含まれる。
生化学における存在と機能
タンパク質生成アミノ酸
アミノ酸はタンパク質の前駆体である。アミノ酸は縮合反応によって結合し、ペプチドと呼ばれる短いポリマー鎖、あるいはポリペプチドまたはタンパク質と呼ばれる長い鎖を形成する。これらの鎖は直鎖状で枝分かれしておらず、鎖内の各アミノ酸残基は隣接する2つのアミノ酸に結合している。自然界では、DNA/RNA遺伝物質によってコードされたタンパク質が作られる過程は翻訳:と呼ばれ、リボソームと呼ばれるリボザイムによって、成長するタンパク質鎖にアミノ酸が段階的に付加されていく。アミノ酸が付加される順序は、生物の遺伝子の1つをRNAコピーしたmRNAを鋳型とする遺伝コードによって読み取られる。
22種類のアミノ酸は自然にポリペプチドに組み込まれ、タンパク原性または天然アミノ酸と呼ばれる。このうち20種類は普遍的な遺伝暗号によってコード化されている。残りの2つ、selenocysteineセレノシステインとピロリジンは、独自の合成機構によってタンパク質に組み込まれる。セレノシステインは、翻訳されるmRNAにSECISエレメントが含まれ、UGAコドンが停止コドンの代わりにセレノシステインをコードするようになると組み込まれる。ピロリジンは、いくつかのメタン生成菌古細菌がメタンを生成するための酵素に用いる。これはコドンUAGでコードされ、他の生物では通常停止コドンである。このUAGコドンの後にPYLIS下流配列が続く。
いくつかの独立した進化学的研究により、Gly、Ala、Asp、Val、Ser、Pro、Glu、Leu、Thrは初期の遺伝暗号を構成していたアミノ酸群に属し、Cys、Met、Tyr、Trp、His、Pheは後に遺伝暗号に追加されたアミノ酸群に属する可能性が示唆されている。
標準アミノ酸と非標準アミノ酸の比較
普遍的な遺伝コードのコドンによって直接コードされる20種類のアミノ酸は、標準またはカノニカルアミノ酸と呼ばれる。メチオニンの修飾型(N-ホルミルメチオニン)は、バクテリア、ミトコンドリア、葉緑体のタンパク質の初期アミノ酸として、メチオニンの代わりに組み込まれることが多い。その他のアミノ酸は非標準または非正規と呼ばれる。非標準アミノ酸のほとんどは非タンパク質生成性(翻訳中にタンパク質に取り込まれない)であるが、そのうちの2つは、普遍的遺伝コードにコードされていない情報を利用することで、翻訳によってタンパク質に組み込むことができるため、タンパク質生成能を持つ。
2つの非標準タンパク質生成アミノ酸は、セレノシステイン(多くの非真核生物とほとんどの真核生物に存在するが、DNAによって直接コードされていない)とピロリジン(いくつかの古細菌と少なくとも1つの細菌にのみ存在する)である。これらの非標準アミノ酸が組み込まれることは稀である。例えば、25のヒトタンパク質がその一次構造にセレノシステインを含み、構造的に特徴付けられている酵素(セレノ酵素)は、その活性部位の触媒部位としてセレノシステインを採用している。ピロリジンとセレノシステインは変異コドンを介してコードされている。例えば、セレノシステインは停止コドンとSECIS要素によってコードされる。
N-ホルミルメチオニン(細菌、ミトコンドリア、葉緑体のタンパク質の初期アミノ酸であることが多い)は、一般に、別のタンパク質生成アミノ酸としてではなく、メチオニンの一形態として考えられている。自然界には存在しないコドン-tRNAの組み合わせも、遺伝コードの「拡張」に使われ、非タンパク質生成アミノ酸を組み込んだアロプロテインとして知られる新規タンパク質を形成することができる。
非タンパク質性アミノ酸
22種類のタンパク質生成アミノ酸以外に、多くの非タンパク質生成アミノ酸が知られている。それらはタンパク質に含まれないか(例えばカルニチン、GABA、レボチロキシン)、あるいは標準的な細胞機構によって直接かつ単独では生成されない。例えば、ヒドロキシプロリンである。ヒドロキシプロリンはプロリンから合成される。もう一つの例はセレノメチオニンである。)
タンパク質に含まれる非タンパク質原性アミノ酸は、翻訳後修飾によって形成される。このような修飾はタンパク質の局在を決定することもある。例えば、長い疎水基の付加はタンパク質をリン脂質膜に結合させる。例としては
- グルタミン酸のカルボキシル化はカルシウムカチオンの結合をより良くする、
- ヒドロキシプロリンはプロリンのヒドロキシル化によって生成され、結合組織コラーゲンの主要成分である。
- 翻訳開始因子のヒプシンEIF5Aは、リジンの修飾を含んでいる。
非タンパク質生成アミノ酸の中には、タンパク質に含まれないものもある。例えば、2-アミノイソ酪酸や神経伝達物質であるγ-アミノ酪酸などである。非タンパク質原性アミノ酸は、標準アミノ酸の代謝経路の中間体として生じることが多い -例えば、オルニチンとシトルリンは、アミノ酸の異化の一部である尿素サイクルで生じる(下記参照)。生物学におけるα-アミノ酸の優位性に対するまれな例外はβ-アミノ酸βアラニン(3-アミノプロパン酸)であり、これは植物や微生物において補酵素Aの成分であるパントテン酸(ビタミンB5)の合成に用いられる。
哺乳類の栄養

アミノ酸は食品の典型的な成分ではない。動物はタンパク質を食べる。タンパク質は消化の過程でアミノ酸に分解される。アミノ酸はその後、新しいタンパク質や他の生体分子の合成に使われたり、エネルギー源として尿素と二酸化炭素に酸化されたりする。酸化経路はトランスアミナーゼによるアミノ基の除去から始まり、アミノ基はその後尿素サイクルに供給される。トランスアミド化のもう1つの生成物はケト酸で、クエン酸サイクルに入る。糖原性アミノ酸はまた、糖新生によってグルコースに変換される。
20種類の標準アミノ酸のうち、9種類(His、Ile、Leu、Lys、Met、Phe、Thr、 Trp、Val)は、人体が正常な成長に必要なレベルで他の化合物から合成できないため、食物から摂取しなければならず、必須アミノ酸と呼ばれている。
準必須アミノ酸と条件付き必須アミノ酸、および幼少期の必要量
さらに、システイン、チロシン、アルギニンは準必須アミノ酸とみなされ、タウリンは小児では準必須アミノスルホン酸である。一部のアミノ酸は、特定の年齢や病状に条件付き必須である。必須アミノ酸も種によって異なる場合がある。これらのモノマーを合成する代謝経路は完全には発達していない。
タンパク質以外の機能
ヒトの場合、アミノ酸は多様な生合成経路においても重要な役割を担っている。植物の草食動物に対する防御では、アミノ酸が使われることがある。例えば、以下のようなものがある:
標準アミノ酸
- トリプトファンは神経伝達物質セロトニンの前駆体である。
- チロシン(およびその前駆体のフェニルアラニン)はカテコールアミン神経伝達物質であるドーパミン、エピネフリン、ノルエピネフリン、さまざまな微量アミンの前駆体である。
- フェニルアラニンは、ヒトではフェネチルアミンとチロシンの前駆体である。植物では、植物の代謝に重要な様々なフェニルプロパノイドの前駆体である。
- グリシンはヘムなどのポルフィリンの前駆体である。
- アルギニンは一酸化窒素の前駆体である。
- オルニチンとS-アデノシルメチオニンはポリアミンの前駆体である。
- アスパラギン酸、グリシン、グルタミンはヌクレオチドの前駆体である。しかし、他の豊富な非標準アミノ酸の機能のすべてではない。
非標準アミノ酸の役割
- カルニチンは脂質輸送に使われる。
- γ-アミノ酪酸は神経伝達物質である。
- 5-HTP(5-ヒドロキシトリプトファン)はうつ病の実験的治療に用いられる。
- L-DOPA(L-ジヒドロキシフェニルアラニン)はパーキンソン病の治療に用いられる、
- エフロルニチンはオルニチン脱炭酸酵素を阻害し、眠り病の治療に用いられる。
- カナバニン(アルギニンの類似体)は多くのマメ科植物に含まれており、植物を捕食者から守る摂食阻害物質である。
- いくつかのマメ科植物に含まれるミモシンもまた摂食阻害物質の可能性がある。この化合物はチロシンのアナログであり、これらの植物を草食する動物を毒殺することができる。
産業における用途
動物用飼料
アミノ酸が動物用飼料に添加されることがあるのは、大豆などの飼料の成分には、いくつかの必須アミノ酸、特にリジン、メチオニン、スレオニン、トリプトファンのレベルが低いからである。同様に、アミノ酸は、飼料サプリメントからのミネラルの吸収を改善するために、金属陽イオンをキレートするために使用される。
食品
食品産業はアミノ酸、特に旨味調味料として使用されるグルタミン酸、人工甘味料として使用されるアスパルテーム(アスパルチルフェニルアラニン1-メチルエステル)の主要な消費者である。アミノ酸は、ミネラルの吸収を改善し、無機ミネラルの補給による副作用を軽減することで、貧血などのミネラル不足の症状を緩和するために、メーカーが食品に添加することがある。
化学的構成要素
アミノ酸はキラルプール合成において|エナンチオマー的に純粋なビルディングブロックとして使用される低コストの原料である。
アミノ酸はいくつかの化粧品の合成に使われる。
意欲的な用途
肥料
アミノ酸のキレート化能力は、鉄クロロシスなどのミネラル欠乏症を改善するために、植物へのミネラルの供給を促進するために肥料に使用されることがある。これらの肥料はまた、欠乏症の発生を予防し、植物の全体的な健康状態を改善するためにも使用される。
生分解性プラスチック
アミノ酸は生分解性ポリマーの成分として考えられており、環境に優しい包装材として、また薬物送達や人工インプラントの構築といった医療分野での応用がある。このような材料の興味深い例として、使い捨て紙おむつや農業への応用が期待される水溶性の生分解性ポリマーであるポリアスパラギン酸塩がある。その溶解性と金属イオンをキレートする能力から、ポリアスパラギン酸塩は生分解性の防汚剤や腐食防止剤としても使用されている。
合成

化学合成
アミノ酸の商業的生産は通常、グルコースを炭素源として個々のアミノ酸を過剰生産する変異細菌に依存している。いくつかのアミノ酸は、合成中間体の酵素変換によって生産される。例えば、2-アミノチアゾリン-4-カルボン酸はL-システインの工業的合成の中間体である。アスパラギン酸は、リアーゼを用いたフマル酸へのアンモニアの付加によって生成される。
生合成
植物では、窒素はまずミトコンドリア内でα-ケトグルタル酸とアンモニアから生成されるグルタミン酸の形で有機化合物に同化される。他のアミノ酸については、植物はトランスアミナーゼを用いてグルタミン酸から別のα-ケト酸にアミノ基を移動させる。例えば、アスパラギン酸アミノトランスフェラーゼは、グルタミン酸とオキサロ酢酸をα-ケトグルタル酸とアスパラギン酸に変換する。他の生物もアミノ酸合成にトランスアミナーゼを使っている。
非標準アミノ酸は通常、標準アミノ酸の修飾によって形成される。例えば、ホモシステインは中間代謝産物S-アデノシルメチオニンを介したトランス硫酸化経路またはメチオニンの脱メチル化によって形成され、ヒドロキシプロリンはプロリンの翻訳後修飾によって作られる。
微生物や植物は、多くの珍しいアミノ酸を合成する。例えば、2-アミノイソ酪酸やアラニンの硫化架橋誘導体であるランチオニンを作る微生物もいる。これらのアミノ酸はどちらも、アラメチシンのようなペプチド性のランティバイオティクスに含まれている。しかし植物では、1-アミノシクロプロパン-1-カルボン酸は小さな二置換環状アミノ酸であり、植物ホルモンエチレンの生成の中間体である。
原始合成
アミノ酸とペプチドの形成は、地球上の生命の発生に先行し、おそらくそれを誘発すると考えられている。アミノ酸は様々な条件下で単純な前駆体から形成される。アミノ酸や非常に小さな化合物の表面化学代謝によって、アミノ酸、補酵素、リン酸ベースの小さな炭素分子が蓄積された可能性がある。アミノ酸や類似の構成要素は、プロトペプチドに精巧化された可能性があり、ペプチドは生命の起源において重要な役割を果たすと考えられている。
有名なユーレイ・ミラー実験では、メタン、水素、アンモニアの混合物に電気アークを通すと、大量のアミノ酸が生成された。それ以来,科学者たちは,凝縮剤,自己複製ペプチドの設計,アミノ酸が出現してペプチドに精緻化する多くの非酵素的メカニズムなど,ペプチドの潜在的なプレバイオティック形成と化学進化が起こったかもしれない様々な方法と構成要素を発見してきた。いくつかの仮説は、シアン化水素、単純なアルデヒド、アンモニア、水がアミノ酸を生成するStrecker合成を提唱している。
ある総説によれば、アミノ酸、そしてペプチドさえも、「単純な化学物質から調理された様々な実験用スープの中に、かなり規則的に出てくる。なぜなら、ヌクレオチドはアミノ酸よりも化学的に合成するのがはるかに難しいからである。」 時系列的な順序としては、「タンパク質の世界」か少なくとも「ポリペプチドの世界」があったはずで、おそらくその後に「RNAの世界」と「DNAの世界」が続いたのだろうということを示唆している。コドン-アミノ酸のマッピングは、地球上の生命の原初の起源における生物学的情報システムであったかもしれない。アミノ酸、ひいては単純なペプチドは、実験的に証明されたさまざまな地球化学的シナリオのもとで形成されたに違いないが、無生物世界から最初の生命体への移行は、まだ未解決の部分が多い。
反応
アミノ酸は、構成する官能基に期待される反応を起こす。
ペプチド結合の形成

アミノ酸のアミン基とカルボン酸基の両方が反応してアミド結合を形成することができるため、あるアミノ酸分子が別のアミノ酸分子と反応し、アミド結合を介して結合することができる。このアミノ酸の重合がタンパク質を作り出す。この縮合反応によって、新しく形成されたペプチド結合と1分子の水が得られる。細胞内では、この反応は直接起こるのではなく、まずアミノ酸がエステル結合を介して転移RNA分子に結合することで活性化される。このアミノアシルtRNAは、アミノアシルtRNA合成酵素によって行われるATP依存的反応で生成される。このアミノアシルtRNAは次にリボソームの基質となり、リボソームは伸長するタンパク質鎖のアミノ基のエステル結合への攻撃を触媒する。このメカニズムの結果、リボソームによって作られる全てのタンパク質は、そのN末端から始まり、C末端に向かって合成される。
しかし、すべてのペプチド結合がこのようにして形成されるわけではない。いくつかの場合、ペプチドは特定の酵素によって合成される。例えば、トリペプチドグルタチオンは、酸化ストレスに対する細胞の防御に不可欠な部分である。このペプチドは遊離アミノ酸から2段階で合成される。最初のステップでは、γ-グルタミルシステイン合成酵素が、グルタミン酸の側鎖カルボキシル(この側鎖のγ炭素)とシステインのアミノ基の間に形成されるペプチド結合を介して、システインとグルタミン酸を縮合させる。このジペプチドは次にグルタチオン合成酵素によってグリシンと縮合してグルタチオンを形成する。
化学では、ペプチドは様々な反応によって合成される。最もよく使われる固相ペプチド合成のひとつは、活性化ユニットとしてアミノ酸の芳香族オキシム誘導体を使う。固相ペプチド合成では、活性化ユニットとしてアミノ酸の芳香族オキシム誘導体を使用し、成長するペプチド鎖に順番に付加していく。ペプチドのライブラリーはハイスループットスクリーニングを通じて薬物発見に使われる。
官能基の組み合わせにより、アミノ酸は金属-アミノ酸キレートの効果的な多座配位子となる。 アミノ酸の複数の側鎖は化学反応を起こすこともできる。
異化

* 糖原性、生成物は糖新生によってグルコースを形成する能力を持つ。
* ケトジェニック、グルコースを形成する能力を持たない。これらの生成物はまだケトジェネシスまたは脂質合成のために使用されるかもしれない。
*アミノ酸はグルコース生成とケトン生成の両方に異化される。
アミノ酸の分解には、そのアミノ基をα-ケトグルタル酸に移動させ、グルタミン酸を形成する脱アミノ化がしばしば関与する。このプロセスにはトランスアミナーゼが関与し、多くの場合、合成時のアミノ化で使われるものと同じである。多くの脊椎動物では、アミノ基はその後尿素サイクルを通じて除去され、尿素の形で排泄される。しかし、アミノ酸の分解によって代わりに尿酸やアンモニアが生成されることもある。例えば、セリンデヒドラターゼはセリンをピルビン酸とアンモニアに変換する。1つ以上のアミノ基を除去した後の分子の残りは、新しいアミノ酸を合成するために使われることもあるし、右の画像に詳しくあるように、解糖やクエン酸サイクルに入ることでエネルギーとして使われることもある。
複合化
アミノ酸は二座配位子であり、遷移金属アミノ酸錯体を形成する。
化学分析
有機物に含まれる全窒素は、主にタンパク質中のアミノ基によって形成される。全ケルダール窒素(TKN)は、(排水)、土壌、食品、飼料、有機物全般の分析に広く用いられる窒素の指標である。その名の通り、ケルダール法が適用される。より感度の高い方法もある。
こちらも参照
さらに読む
- Tymoczko JL (2012). "Protein Composition and Structure". Biochemistry. New York: W. H. Freeman and company. pp. 28–31. ISBN 9781429229364.
- Doolittle RF (1989). "Redundancies in protein sequences". In Fasman GD (ed.). Predictions of Protein Structure and the Principles of Protein Conformation. New York: Plenum Press. pp. 599–623. ISBN 978-0-306-43131-9. LCCN 89008555.
- Nelson DL, Cox MM (2000). Lehninger Principles of Biochemistry (3rd ed.). Worth Publishers. ISBN 978-1-57259-153-0. LCCN 99049137.
- Meierhenrich U (2008). Amino acids and the asymmetry of life (PDF). Berlin: Springer Verlag. ISBN 978-3-540-76885-2. LCCN 2008930865. Archived from the original (PDF) on 12 January 2012.
外部リンク
 Media related to Amino acid at Wikimedia Commons
Media related to Amino acid at Wikimedia Commons