脂質異常症
| 脂質異常症 | |
|---|---|
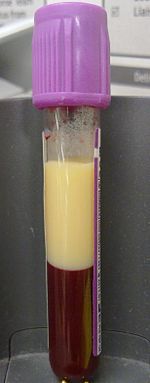 | |
| EDTAをバキュテイナーに入れた高脂血症の血液を4ml採取した形の脂質異常症の例である。 遠心分離せずに4時間静置すると、脂質は上部画分に分離した。 | |
| Specialty | 循環器学 |
| Symptoms | アテローム性動脈硬化症 |
| Complications | Cardiovascular disease/ja, coronary artery disease/ja |
| Types | 高脂血症, hypolipidemia/ja |
脂質異常症(Dyslipidemia)は、血液中の脂質(例えば、脂肪、トリグリセリド、コレステロール、リン脂質)またはリポ蛋白の量が異常に多いか少ないことを特徴とする代謝異常である。脂質異常症は、冠動脈疾患、脳血管疾患、末梢動脈疾患を含む動脈硬化性心血管系疾患(ASCVD)発症の危険因子である。脂質異常症はASCVDの危険因子であるが、異常値だからといって脂質低下薬を開始する必要はない。心血管リスク評価では、脂質異常症に加えて併存疾患や生活習慣などの他の因子も考慮する。先進国では、ほとんどの脂質異常症は高脂血症である。これはしばしば食事やライフスタイルに起因する。長期にわたるインスリン抵抗性の上昇も脂質異常症につながる。同様に、O-GlcNAc転移酵素(OGT)の上昇も脂質異常症を引き起こすことがある。
種類
| 増加 | 減少 | |
|---|---|---|
| 脂質 |
|
|
| Lipoprotein/ja |
|
|
| 両方 |
|
診断
分類
医師や基礎研究者は脂質異常症を2つの方法で分類している。ひとつは体内での発現(増加する脂質の種類を含む)である。もう1つは、その病態の根本的な原因(遺伝、または他の病態による二次的なもの)によるものである。ほとんどの疾患は遺伝と生活習慣の問題が交差しているため、この分類には問題がある。しかし、明確に定義された遺伝的疾患がいくつかあり、通常は容易に特定できる。
脂質異常症を評価するために採取される主な血中濃度は、トリグリセリド値(TG)、高密度リポ蛋白コレステロール値(HDL-C)、および低密度リポ蛋白コレステロール値(LDL-C)の3つである。高トリグリセリド値(空腹時1.7 mmol/L以上)は脂質異常症を示すことがある。トリグリセリドは超低比重リポ蛋白(VLDL)を担体として血液中を輸送される。トリグリセリド値を測定する際の注意点として、空腹時でないTGの結果は誤って上昇する可能性があるため、正確な結果を得るためには8~12時間の絶食が必要である。TGの結果が10 mmol/Lを超える場合、重度の高トリグリセリド血症は急性膵炎の危険因子であるため、対処する必要がある。脂質異常症を評価するために採取されるもう一つの血中濃度はHDL-Cである。HDLコレステロールは、ごくわずかな脂質と多量のタンパク質で構成されている。組織に行って余分なコレステロールや脂肪を拾い上げる働きをするため、体内では有益である。HDL-Cのポジティブな作用により、プラーク形成を防ぐ働きがあるため、「善玉コレステロール」と呼ばれている。HDL-Cのその他の働きは、抗酸化作用、血栓症に対する保護、内皮機能の維持、血液の低粘度維持など、心臓血管の健康を促進することである。HDLコレステロールの積極的な働きにより、低値は脂質異常症を示し、合併症の危険因子となる。もう一つの診断検査は、LDLコレステロールである。低密度リポ蛋白はコレステロール、TG、リン脂質、アポリポ蛋白から構成されている。LDL-C分子は血管内皮に結合し、プラーク形成を引き起こす。プラークが形成されると、血流中に浮遊するLDL-Cがプラークに付着し、さらなる蓄積を引き起こす。プラーク形成に加えて、LDL-C分子は酸化を受ける。酸化はコレステロールのさらなる蓄積と炎症性サイトカインの放出を引き起こし、血管を損傷する。LDL-Cの損傷作用により、高値は心血管疾患のリスクを高め、脂質異常症を示す。
脂質異常症はまた、一次性、二次性、またはその両方の組み合わせのいずれであるかという根本的な原因に基づいて分類することができる。一次性脂質異常症は、遺伝的疾患によって引き起こされ、他の明らかな危険因子を伴わずに脂質レベルの異常を引き起こす。原発性脂質異常症の人は、アテローム性心血管病などの脂質異常症の合併症を若年で発症するリスクが高い。原発性脂質異常症に関連する一般的な遺伝性疾患には、ホモ接合性またはヘテロ接合性高コレステロール血症、家族性高トリグリセリド血症、複合型高脂血症、HDL-C代謝異常症などがある。家族性高コレステロール血症では、通常LDLR、PCSK9、APOBの変異が原因であり、これらの変異によりLDLコレステロールが高くなる。複合型高脂血症では、肝臓でアポB-100が過剰産生される。このためLDLとVLDL分子が多量に形成される。原発性脂質異常症の特徴的な徴候は、患者がしばしば急性膵炎または皮膚、眼瞼または角膜周囲に黄色腫を呈することである。一次性脂質異常症とは対照的に、二次性脂質異常症は修正可能な環境因子または生活習慣因子に基づく。脂質異常症のリスクが高い疾患としては、コントロールされていない糖尿病、胆汁うっ滞性肝疾患、慢性腎臓病、甲状腺機能低下症、多嚢胞性卵巣症候群などがある。また、過度のアルコール摂取、炭水化物の摂りすぎ、飽和脂肪酸の多い食事もリスクが高い。脂質異常症の原因となる医薬品としては、サイアザイド系利尿薬、β遮断薬、経口避妊薬、非定型抗精神病薬(クロザピン、オランザピン)、コルチコステロイド、タクロリムス、シクロスポリンなどがある。脂質異常症のリスクを高める非遺伝的因子としては、喫煙、妊娠、肥満などがある。
以下に示すフレデリクソン分類では、脂質異常症をカテゴリーに分類している:
| 表現型 | I | IIa | IIb | III | IV | V |
|---|---|---|---|---|---|---|
| リポ蛋白の上昇 | カイロミクロン | LDL | LDLとVLDL | IDL | VLDL | VLDLとカイロミクロン |
スクリーニング
脂質異常症のスクリーニングをいつ開始すべきかについて、明確なコンセンサスは得られていない。一般に、心血管疾患のリスクが高い人は、男性は25~30歳、女性は30~35歳の若い年齢でスクリーニングを受けるべきである。症状のない40歳未満の一般住民を検査しても有益性は不明である。UpToDateでは、心血管疾患のリスクがない場合は、男性は35歳、女性は45歳でスクリーニングすることを提案している。年齢に関係なく、以下に挙げる危険因子がある場合は、すべての人がスクリーニングを受けるべきである。心血管リスクはフラミンガムリスクスコア(FRS)を用いて決定することができ、40~75歳の患者では5年ごとに再評価すべきである。
危険因子
危険因子には以下のようなものがある:
- 脂質異常症の家族歴
- 現在の喫煙
- 糖尿病
- 高血圧
- 肥満(BMI>30 kg/m2)
- 動脈硬化
- 早発性冠動脈疾患の家族歴
- HIV感染
- 勃起不全
- 慢性腎臓病(eGFR<60ml/分/1.73m2)
- 腹部動脈瘤
- 慢性閉塞性肺疾患
- 高脂血症の臨床症状(黄色腫、黄色腫、早発性角膜円弧症)
- 妊娠高血圧症候群
- 炎症性腸疾患
非薬物療法の選択
脂質異常症における重要な非薬理学的介入は、血中脂質レベルの低下を目的とした食事療法であり、必要であれば減量も行う。このような食事療法は常に治療の一部であるべきであり、初期評価だけでなく経過観察においても管理栄養士の関与が推奨される。一次予防では、医薬品を検討する前に3ヵ月間の食事療法の試行が推奨されるが、二次予防やハイリスク者では、食事療法とともにコレステロール低下薬が使用される。
推奨される食事としては、DASH食、地中海食、低グリセミック指数食、ポートフォリオ食、ベジタリアン食などがある。患者は飽和脂肪、食事性コレステロール、アルコールの摂取を減らし、総繊維(30g/日)、粘性水溶性繊維(10g/日)、オメガ3(EPAとDHA[2-4g/日]はTG低下のみに使用)の摂取を増やすべきである。また、一価不飽和脂肪と多価不飽和脂肪の摂取割合を増やすべきである。
その他の生活習慣の改善としては、減量(体重の5~10%減)と腹部肥満の軽減、1日30~60分の適度な運動、禁煙、ストレス管理、夜間6~8時間の睡眠などがある。
薬理学的選択
フラミンガムリスクスコアに基づいて、治療を開始すべきかどうかを示すさまざまな閾値がある。スコアが20%の人は心血管リスクが高く、10~19%の人は中間リスク、10%未満の人は低リスクである。心血管リスクが高い患者にはスタチン治療と非薬物療法が適応となる。
中等度リスクまたは低リスクの患者では、スタチン治療の使用は年齢、コレステロール値、危険因子などの個々の患者因子によって異なる。
スタチンは第一選択薬と考えられているが、スタチン治療で脂質目標値が達成されない場合、あるいはスタチン治療に耐えられない場合は、他の薬物で代用することができる。
HMG-CoA還元酵素阻害薬(スタチン)
スタチンはコレステロールの生合成に使われるヒドロキシメチルグルタリル(HMG)CoA還元酵素を競合的に阻害する薬で、アトルバスタチン、ロバスタチン、シンバスタチン、ロスバスタチン、プラバスタチン、フルバスタチン、ピタバスタチンなどがある。これらの薬剤はLDL-C値を低下させる作用があり、CVD死亡率、CVD罹患率、総死亡率の低下にも関係している。これらの薬剤はHDL-C値にもわずかながら影響を及ぼす。
レジン類
レジン類は胆汁酸封鎖剤であり、胆汁酸の腸への再取り込みを阻害することにより、胆汁酸の糞便中への排出を増加させ、失われた胆汁酸の代わりに肝臓でのコレステロールの利用を促進する。樹脂にはコレスチラミン、コレスチポール、コレスバレムなどがあり、いずれもLDL-Cを減少させる一方、HDL-C値をわずかに上昇させる。Lipid Research Council - Cardiovascular Primary Prevention Trial(LRC-CPPT)でも、これらの薬剤を単独で使用した場合、心血管系の転帰を改善することが示された。
フィブラート系
フィブラートのコレステロール低下作用は、ペルオキシソーム増殖剤活性化受容体αと呼ばれる核内受容体を活性化する能力によるものである。フィブラート系薬物には、フェノフィブラート、ゲムフィブロジル、ベザフィブラートなどがあり、トリグリセリドを減少させ、HDL-Cを増加させ、LDL-Cを減少させる作用があるが、どの薬物を使用するかによって異なる。FIELD試験では、フェノフィブラートが冠動脈血行再建術および非致死的心筋梗塞を減少させることが示された(ただし、2型糖尿病患者では減少しなかった)。
PCSK9阻害薬
PCSK9阻害薬は、プロタンパク質転換酵素サブチリシン/ケキシン9型(PCSK9)と呼ばれるLDLの分解に重要なタンパク質を標的とするモノクローナル抗体である。これらの薬剤はLDL-Cを減少させ、HDL-Cを増加させ、トリグリセリドを減少させ、リポ蛋白(a)を減少させる。FOURNIER試験とODYSSEY試験では、これらの薬剤が心血管イベントのリスクも低下させることが示された。
コレステロール吸収阻害薬
エゼチミブはコレステロールの腸管吸収を阻害し、単独またはスタチン系薬剤と併用することができる。心血管イベントに関しては、慢性腎臓病患者にシンバスタチンとエゼチミブを併用した場合、プラセボと比較して血管イベントと主要アテローム性動脈硬化性イベントが減少した。この同じ組み合わせは、急性冠症候群後の患者において、死亡、主要冠動脈イベント、非致死的脳卒中を減少させることも示された。
イコサペントエチル
イコサペントエチルは魚油由来のオメガ3脂肪酸であるエイコサペンタエン酸(EPA)を主成分とし、トリグリセリドの肝生成を低下させる。REDUCE-IT試験では、スタチン治療を受けている患者に1日4gのイコサペントエチルを投与したところ、主要心血管系イベントの減少がみられた。
ミクロソーム・トリグリセリド・トランスファー・プロテイン阻害薬
ロミタピドは、ミクロソーム・トリグリセリド転移蛋白(MTP)を阻害する作用があり、その結果、血漿中のLDL濃度を低下させる。
ATP クエン酸リアーゼ阻害薬
ベンペド酸は、ATPクエン酸リアーゼにおいてスタチンより上流のコレステロール合成経路に作用する。この酵素はミトコンドリアからのクエン酸を用いてアセチル-CoAを合成する。
コレステリルエステル転移蛋白阻害薬
コレステリルエステル転移蛋白(CETP)阻害薬には、トルセトラピブ、アナセトラピブ、オビセトラピブなどがある。これらは、「善玉」HDL粒子から「悪玉」LDL粒子へのコレステロールの移動を阻害し、HDL:LDL比の上昇を引き起こす。血中脂質に好ましい変化をもたらすにもかかわらず、ほとんどのCETP阻害薬(アナセトラピブを除く)は心血管イベントを有意に減少させることはない。