低密度リポ蛋白質

低比重リポ蛋白(LDL)は、リポ蛋白の5つの主要なグループの1つであり、細胞外水中で体内のすべての脂肪分子を輸送する。これらのグループは、最も密度の低いものから順に、カイロミクロン(全体密度の命名規則では別名ULDL)、超低比重リポ蛋白(VLDL)、中比重リポ蛋白(IDL)、低比重リポ蛋白(LDL)、および高比重リポ蛋白(HDL)である。LDLは脂肪分子を細胞に送り込む。LDLは動脈の壁内で酸化される過程であるアテローム性動脈硬化症に関与している。
概要
リポタンパク質は、細胞外液中で脂質(脂肪)を体中に移動させ、脂肪を体細胞が受容体を介したエンドサイトーシスで利用できるようにする。リポ蛋白質は複数の蛋白質から成る複合粒子であり、通常1粒子あたり80~100個の蛋白質から成る(LDLおよびそれ以上の粒子では単一のアポリポ蛋白質Bによって組織化されている)。1個のLDL粒子の直径は約220~275オングストロームで、通常1粒子あたり3,000~6,000個の脂肪分子を運搬し、中に含まれる脂肪分子の数と組み合わせによって大きさが変わる。運搬される脂質には、コレステロール、リン脂質、トリグリセリドを主成分とするすべての脂肪分子が含まれるが、それぞれの量はかなり異なる。
血中脂質値に関する一般的な臨床的解釈は、LDLが高いと心血管疾患のリスクが高まるというものである。
生化学
構造
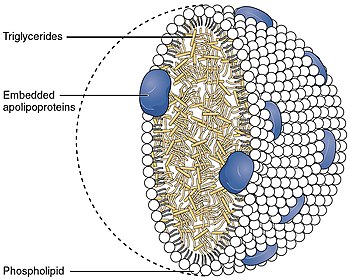
それぞれのネイティブLDL粒子は乳化を可能にし、すなわち運ばれる脂肪酸を取り囲み、これらの脂肪が細胞外の水中で体内を移動することを可能にする。各粒子には1個のアポリポ蛋白質が含まれている。B-100分子(Apo B-100、4536個のアミノ酸残基と514kDaの質量を持つ蛋白質)と80から100個の補助蛋白質が含まれている。各LDLは、リノレイン酸として知られる多価不飽和脂肪酸と、数百から数千(平均値として一般的に引用される約1500)のエステル化および非エステル化コレステロール分子から成る高度に疎水性のコアを持つ。このコアはまた、様々な数のトリグリセリドや他の脂肪を運び、リン脂質と未エステル化コレステロールの殻、およびApo B-100の単一コピーに囲まれている。LDL粒子の直径は約22~27.5nmで、質量は約300万ダルトンである。LDL粒子は脂肪酸分子の数が変化するため、LDL粒子の質量と大きさには分布がある。LDLの構造を決定することは、その不均一な構造のために困難な課題であった。しかし2011年、極低温電子顕微鏡を用いて、約16オングストロームの分解能で、ヒトの体温におけるLDLの構造が明らかにされた。
生理学
LDL粒子は、リポタンパク質リパーゼ酵素(LPL)によってVLDLからトリグリセリドが除去されると形成され、より小さく高密度(すなわち、同じタンパク質輸送シェルでより少ない脂肪分子)になり、より高い割合のコレステロールエステルを含む。
細胞内へのコレステロール輸送
細胞が(現在の内部HMGCoA産生経路を超えて)さらなるコレステロールを必要とする場合、細胞は必要なLDL受容体を合成するとともに、LDL受容体を分解のためにマークするプロテイン転換酵素であるPCSK9を合成する。LDL受容体は細胞膜に挿入され、クラスリンでコートされたピットと会合するまで自由に拡散する。LDL受容体が血流中のLDL粒子と結合すると、クラスリンでコートされたピットが細胞内にエンドサイトーシスされる。
LDLと結合したLDL受容体を含む小胞はエンドソームに送られる。エンドソームに見られるような低いpHの存在下では、LDL受容体はコンフォメーション変化を起こし、LDLを放出する。LDLはその後リソソームに送られ、そこでLDL中のコレステロールエステルが加水分解される。LDL受容体は通常細胞膜に戻され、そこでこのサイクルを繰り返す。しかし、LDL受容体がPCSK9と結合すると、LDL受容体の輸送はリソソームへと方向転換され、そこで分解される。
===自然免疫系における役割====。 LDLは、侵襲性黄色ブドウ球菌感染に必要な遺伝子をアップレギュレートするクオラムセンシングシステムを妨害する。拮抗のメカニズムとしては、アポリポタンパク質Bが黄色ブドウ球菌の自己誘導物質フェロモンに結合し、その受容体を介したシグナル伝達を阻害することが挙げられる。アポリポタンパク質Bを欠損したマウスは、侵襲性細菌感染症にかかりやすくなる。
LDLのサイズパターン
LDLはその大きさによってグループ分けすることができる。大きな低密度LDL粒子はパターンA、小さな高密度LDL粒子はパターンBと表現される。パターンBは冠動脈性心疾患のリスクが高いという報告がある。これは、粒子が小さいほど動脈壁の内皮を透過しやすいためと考えられている。パターンIは中間を意味し、ほとんどのLDL粒子が内皮の正常な隙間(26 nm)に非常に近いサイズであることを示している。ある研究によると、19.0-20.5 nmの大きさのLDLはパターンBとされ、20.6-22 nmの大きさのLDLはパターンAとされている。
パターンBと冠動脈性心疾患との相関は、標準的な脂質プロファイル検査で測定されるLDL数値との対応よりも強いことを示唆する証拠もある。これらのLDLサブタイプパターンを測定する検査は高価であり、広く普及していないため、一般的な脂質プロファイル検査がより多く用いられている。
また、トリグリセリド値が高くなると、より小さく密度の高いLDL粒子の値が高くなり、逆にトリグリセリド値が低くなると、より大きく密度の低い(「浮遊性」)LDLの値が高くなるという対応関係も指摘されている。
NMR分光法を含む他のリポ蛋白サブクラス分析測定法の継続的な研究、コストの低下、入手しやすさの向上、および広く受け入れられるようになったことで、ヒトの臨床的に明らかな心血管系イベントと定量的に測定された粒子濃度との間には、より強い相関関係があることが研究により示され続けている。
酸化LDL
酸化LDLとは、構造成分が酸化的に変化したLDL粒子の総称である。その結果、フリーラジカル攻撃により、LDLの脂質部分とタンパク質部分の両方が血管壁中で酸化される。血管壁で起こる酸化反応の他に、LDL中の酸化脂質は酸化した食事性脂質にも由来する。 酸化LDLはアテローム性動脈硬化症の発症に関与することが知られており、心血管疾患の潜在的な危険因子として広く研究されている。酸化LDLのアテローム性は、LDLレセプターによる酸化修飾LDL構造の認識不足によって説明されており、LDL粒子の正常な代謝を妨げ、最終的にアテローム性動脈硬化斑の発生につながる。LDLに含まれる脂質のうち、様々な脂質酸化産物は究極の動脈硬化種として知られている。これらの有害分子のトランスポーターとして働くことも、LDLが動脈硬化のリスクを増大させるもう一つのメカニズムである。
検査
血液検査では一般的にLDL-Cが報告される。LDL-Cとは、Friedewald方程式と呼ばれる計算式を用いて、平均的にLDL粒子に含まれると推定されるコレステロールの量である。臨床的には、数学的に計算されたLDL-Cの推定値は、低比重リポ蛋白が動脈硬化を進行させている量の推定値として一般的に使用されている。この方法の問題点は、LDL-Cの値が、LDL粒子の直接測定値や動脈硬化の実際の進行速度の両方と一般に不一致であることである。
LDLの直接測定も利用可能であり、個々の問題をよりよく明らかにするが、費用がやや高く、米国では2、3の検査室でしか利用できないため、あまり宣伝されず、実施されることもない。2008年、ADAとACCは、NMRによるLDL粒子の直接測定が心血管イベントの個々のリスクを評価する上で優れていると認めた。
コレステロール含量からLDL粒子を推定する
脂質濃度の化学的測定は、長い間、臨床で最も使用されてきた測定法であるが、その理由は、個々の転帰との相関が最も高いからではなく、これらの検査法が安価で広く入手可能だからである。
脂質プロファイルはLDL粒子を測定しない。Friedewald式を用いて推定するだけである。 HDLやVLDLなどの他の粒子に関連するコレステロールの量を差し引くことによって、長時間の絶食状態などを仮定する:
- ここで、HはHDLコレステロール、LはLDLコレステロール、Cは総コレステロール、Tはトリグリセリドであり、kはmg/dL単位なら0.20、mmol/L単位なら0.45である。
この方法には限界があり、特に12~14時間の絶食後に検体を採取しなければならないことと、血漿中のトリグリセリドが4.52 mmol/L(400 mg/dL)を超えるとLDL-Cを算出できないことが挙げられる。トリグリセリド値が2.5~4.5 mmol/Lの場合でも、この計算式は不正確であると考えられている。 総コレステロール値とトリグリセリド値の両方が高い場合は、量をmg/dLで表した修正式を使用することができる。
この計算式は、約14時間以上の絶食後に採血されたと仮定すれば、ほとんどの人にほぼ正確な近似値を提供するが、LDL粒子内の脂肪分子のうちコレステロールの割合は8:1とばらつきがあるため、実際のLDL粒子濃度を明らかにすることはできない。 LDL-C推定値の不正確さについては、いくつかの計算式が発表されている。その不正確さは、VLDL-C(超低比重リポ蛋白コレステロール)が常にトリグリセリド濃度の5分の1であるという仮定に基づいている。最近発表された新しい計算式は、調整可能な係数を使用するか、回帰式を使用することによって、この問題に対処している。この最近発表された計算式から得られたLDL-C値と直接酵素法で得られた値を比較した研究はほとんどない。直接酵素法は正確であることが判明しており、臨床の場面で選択すべき検査である。資源に乏しい環境では、この計算式を使用するという選択肢も考慮しなければならない。
しかし、LDL-Cの推定値がほぼ正しいとしても、LDL粒子の濃度、およびその大きさは、LDL粒子内のコレステロール量よりも、個々の臨床転帰と強く一貫した相関関係がある。LDL粒子のより的を絞った正確な測定の価値について、証拠と認識が高まりつつある。具体的には、LDL粒子の数(濃度)、およびそれほどではないが大きさは、LDL粒子によって運ばれるコレステロール量の化学的測定で得られるよりも、アテローム性動脈硬化の進行および心血管イベントとやや強い相関を示している。LDLコレステロール濃度が低くても、LDL粒子数が多く、心血管イベント発生率が高い可能性がある。これに対応して、LDLコレステロール濃度が比較的高くても、LDL粒子数が少なく心血管系イベント発生率が低いこともありうる。
正常範囲
米国では、米国心臓協会、NIH、NCEPが、空腹時LDL-コレステロール値(推定値または測定値)と心臓病リスクに関する一連のガイドラインを提供している。2005年現在、これらのガイドラインは以下の通りである:
| レベル mg/dL | レベル mmol/L | 解釈 |
|---|---|---|
| 25 to <50 | <1.3 | 心臓動脈壁のアテローム性プラーク発症前の健康な幼児における最適LDLコレステロール値 |
| <70 | <1.8 | LDLコレステロールの最適値は、より低い進行率に対応し、明らかに症候性心血管病が進行していることがわかっている患者に対する目標選択肢として推進される。 |
| <100 | <2.6 | LDLコレステロールが最適であれば、症候性心血管病イベントの発生率はゼロではないが、低くなる。 |
| 100 to 129 | 2.6 to 3.3 | 至適LDL値に近いほど、症候性心血管系疾患の発症率が高い。 |
| 130 to 159 | 3.3 to 4.1 | ボーダーラインの高LDL値は、症候性心血管系疾患の発症率がさらに高くなる。 |
| 160 to 199 | 4.1 to 4.9 | LDL値が高く、症候性心血管系疾患の発症率が非常に高い。 |
| >200 | >4.9 | LDL値が非常に高く、症候性心血管病イベントの発生率が最も高い。 |
というのも、高コレステロール血症の男性を対象としたある大規模な二重盲検無作為化臨床試験では、LDLを異常低値まで低下させることが心血管死亡率を減少させる最も効果的な戦略であり、冠動脈形成術/ステント留置術やバイパス手術よりもはるかに効果的であったからである。
例えば、既知のアテローム性動脈硬化疾患を持つ人々に対して、2004年に更新された米国心臓協会、NIH、NCEPの勧告は、LDL値を70 mg/dL未満に下げることであり、どの程度下げるかは特定されていない。この70 mg/dL未満という低レベル(ティム・ラサートの心臓発作直前の値より高い)は、「非常にリスクの高い患者」の一次予防に推奨され、二次予防では「合理的なさらなる低下」として推奨された。このような推奨に対するエビデンスの欠如については、Annals of Internal Medicineの論文で論じられている。このような臨床試験に関与しているスタチン製剤は、単にLDL値を低下させるだけでなく、多数の生理学的効果を持っている。
複数のヒトにおける薬理学的LDL低下試験の結果から、心血管イベント発生率をゼロに近づけるためにはLDLを30以下に下げる必要があると推定されている。参考までに、小児期早期から成人期にかけての動脈硬化関連行動の進行を追跡した集団縦断的研究から、脂肪筋が発生する前の小児期の通常のLDLは約35 mg/dLである。しかし、上記の値はすべて、LDL内の脂質/コレステロール濃度の化学的測定値であり、正確なアプローチである低比重リポ蛋白濃度の測定値ではない。
1995年から2004年にかけて、米国における糖尿病受診時のLDLコレステロール報告およびコントロールに対するガイドライン変更の効果を測定する研究が行われた。その結果、1995年から2004年にかけて、糖尿病および冠動脈性心疾患の受診におけるLDLコレステロールの報告とコントロールは継続的に改善したが、1998年のADAガイドラインと2001年のATP IIIガイドラインのいずれも、冠動脈性心疾患と比較して糖尿病におけるLDLコレステロールのコントロールを増加させるものではなかった。
LDL粒子濃度の直接測定
リポタンパク質粒子の濃度と大きさの測定には、いくつかの競合する方法がある。NMR法(Jim Otvosらによって先駆的に開発され、自動化され、精度が向上する一方でコストが大幅に削減された)は、1年以内に心血管系イベントを22-25%減少させるというエビデンスがあり、一部の推進者の発言によっても、既存の方法に対する優位性は弱いとする医療業界の多くの人々による長年の主張に反している。
1990年代後半以降、NMR測定の発展により、臨床的にリポ蛋白粒子をより安価に[米国では80ドル以下(送料を含む)、以前は400~5,000ドル以上かかっていたのに対し、現在では減少傾向にある]、かつ高い精度で測定できるようになった。LDL粒子の測定法は他にも2種類あるが、LDL-Cと同様、ほとんどはLDL粒子濃度を推定するだけである。
NMRによるLDL粒子の直接測定は、2008年3月28日のADAとACCの共同コンセンサス・ステートメントにおいて、動脈硬化性疾患イベントの個人リスクを予測する利点があると言及されたが、このステートメントでは、この検査はあまり広く利用されておらず、より高価である[Vantera Analyzerを使用する一部の検査室では、約13ドル(2015年、保険適用なし)]と指摘されている。LDL粒子サイズの測定がLDL粒子濃度の測定に付加価値を与えるかどうかは不明である。
MESA試験に参加している脂質医薬品を服用していない男女5,382人を対象に、NMRを用いて血漿中の総LDL粒子濃度(nmol/L)をパーセンタイルで細分化するのが一般的である。
最適範囲
LDL粒子濃度は、米国国立心肺血液研究所主催の医学研究であるMESA試験に参加し追跡されている人々のパーセンタイル、<20%、20-50%、50-80%、80-95%、>95%のグループに分類されるのが一般的である。
| MESA パーセンタイル | LDL粒子 nmol/L | 解釈 |
|---|---|---|
| 0–20% | <1,000 | 心血管疾患イベント発生率が最も低く、LDL粒子濃度が低い(至適)者 |
| 20–50% | 1,000–1,299 | 心血管疾患発症率が中程度でLDL粒子濃度が中程度の者 |
| 50–80% | 1,300–1,599 | 境界型-心血管系疾患の発症率が高く、LDL粒子濃度が高い者 |
| 89–95% | 1,600–2,000 | 心血管疾患発症率が高く、LDL粒子濃度がさらに高い者 |
| >95% | >2,000 | 心血管疾患発症率が非常に高く、LDL粒子濃度が最も高い者 |
経時的なアテローム性動脈硬化イベントの発生率が最も低いのは20%未満の群であり、それ以上の群では発生率が高くなる。粒子径、小型LDL粒子濃度、大型総粒子濃度、HDL粒子濃度、インスリン抵抗性パターンの推定値、標準コレステロール脂質測定値(血漿データと上述の推定法との比較のため)など、その他の複数の測定値も定期的に提供される。
LDL-コレステロールを低下させる
| LDL-C値低減の必要性を示すマーカー
(2004年米国政府最低ガイドラインによる) | ||||
|---|---|---|---|---|
| もし患者の心臓リスクが... | mg/dL以上であれば、LDL-Cの減少を考慮すべきである。 | mg/dL以上であれば、LDL-C減少の適応となる。 | ||
| 10年以内に心臓発作を起こす危険性が20%以上、または極端な危険因子である。 | 70 | 100 | ||
| 10年以内に心臓発作を起こすリスクが10~20%あり、心臓発作の危険因子が2つ以上ある。 | 100 | 130 | ||
| 中等度:10年以内の心臓発作のリスクが10%で、心臓発作の危険因子が2つ以上ある。 | 130 | 160 | ||
| 10年以内の心臓発作のリスクが10%未満で、心臓発作の危険因子が1つまたは0つである。 | 160 | 190 | ||
メバロン酸経路はコレステロールを含む多くの分子の生合成の基礎となる。酵素3-ヒドロキシ-3-メチルグルタリルコエンザイムAレダクターゼ(HMG CoAレダクターゼ)は必須成分であり、コレステロール生成経路の37段階のうち最初のステップを実行し、すべての動物細胞に存在する。
LDL-Cは実際のLDL粒子の測定値ではない。LDL-Cは、すべてのLDL粒子によってどれだけのコレステロールが運搬されているかという推定値(個人の血液サンプルから測定したものではない)に過ぎず、大きな粒子の濃度が低いか、小さな粒子の濃度が高いかのどちらかである。LDL粒子は多くの脂肪分子(通常、LDL粒子あたり3,000~6,000個の脂肪分子)を運搬する。これにはコレステロール、トリグリセリド、リン脂質などが含まれる。したがって、平均的なLDL粒子内の数百から数千のコレステロール分子を測定したとしても、他の脂肪分子やLDL粒子の数までは反映されない。
医薬品
- PCSK9阻害薬は、複数の企業による臨床試験において、高用量のスタチン単独(スタチン+エゼチミブの併用とは限らない)を含め、スタチンよりもLDL減少に有効である。
- スタチンは、コレステロール合成の律速段階である細胞内の酵素HMG-CoA還元酵素を阻害することにより、高濃度のLDL粒子を減少させる。コレステロールの利用可能性の減少を補うために、LDL受容体(肝を含む)の合成が増加し、その結果、血液を含む細胞外水からのLDL粒子のクリアランスが増加する。
- エゼチミブは、コレステロールの腸管吸収を低下させるため、スタチンと併用するとLDL粒子濃度を低下させることができる。
- ナイアシン(B3)は、肝ジアシルグリセロールアシルトランスフェラーゼ2を選択的に阻害することによりLDLを低下させ、受容体HM74およびHM74AまたはGPR109Aを介してトリグリセリド合成およびVLDL分泌を低下させる。
- いくつかのCETP阻害薬がHDL濃度を改善するために研究されているが、これまでのところ、HDL-Cを劇的に増加させるにもかかわらず、アテローム性動脈硬化症の発症を減少させるという一貫した実績はない。プラセボと比較して死亡率が上昇したものもある。
- クロフィブラートはコレステロール値を下げるのに有効であるが、コレステロール値が下がったにもかかわらず、癌や脳卒中の死亡率が有意に増加した。他の、より最近開発され試験されたフィブラート系薬剤、例えばフェノフィブリン酸は、より良い実績があり、主にLDL粒子ではなくVLDL粒子(トリグリセリド)を低下させるために促進されているが、他の戦略との併用で多少は効果がある。
- 一部のトコトリエノール、特にデルタ-トコトリエノールとガンマ-トコトリエノールは、試験管内で効果があることが示されており、高コレステロールを治療するためのスタチン代替非処方薬として宣伝されている。特に、γ-トコトリエノールは別のHMG-CoA還元酵素阻害剤であり、コレステロール産生を減少させることができるようである。スタチンと同様に、この肝内(肝臓)LDLレベルの低下は、肝LDLレセプターのアップレギュレーションを誘導し、血漿LDLレベルも低下させる可能性がある。いつものように、重要な問題は、このような薬剤の利点と合併症がスタチン-1970年代半ば以来、多数のヒトの研究および臨床試験で分析されてきた分子ツールとどのように比較されるかである。
- フィトステロール類は、LDLコレステロールを低下させる効果が証明されているものとして広く認知されている。2018年のレビューでは、植物ステロールの用量反応関係が認められ、1.5~3 g/日の摂取でLDL-Cを7.5~12%低下させることがわかったが、2017年時点のレビューでは、植物ステロールの摂取がCVDリスクを低下させる可能性を示すデータは見つかっていない。LDLを減少させるための現在の補足ガイドラインでは、1日あたり1.6~3.0 gの範囲の植物ステロールの摂取が推奨されており(カナダ保健省、EFSA、ATP III、FDA)、2009年のメタアナリシスでは、1日あたり平均2.15 gの摂取でLDL-コレステロールが8.8%減少することが実証されている。
遺伝子編集
2021年、科学者たちはCRISPR遺伝子編集により、肝臓のPCSK9をノックアウトすることで、マカカ・ファスキュラーリスサルの生体内において、LDLコレステロールの血中濃度を数ヶ月にわたって60%低下させることができることを実証した。
ライフスタイル
LDLコレステロールは、飽和脂肪を含む食品を制限し、トランス脂肪を含む食品を避けるという食事介入によって低下させることができる。飽和脂肪は肉製品(鶏肉を含む)、全脂肪乳製品、卵、ココナッツやパームなどの精製された熱帯油に含まれる。しかし、トランス脂肪酸は羊や牛などの反芻動物が少量生産するため、赤身肉や乳製品にも含まれることがある。LDLコレステロールは、水溶性食物繊維と植物性食品の摂取を増やすことによっても低下させることができる。
LDLコレステロールを減少させるためのもう一つのライフスタイルのアプローチは、総体脂肪、特に腹腔内に蓄積された脂肪(内臓脂肪)を最小限に抑えることである。皮下脂肪よりも代謝活性の高い内臓脂肪は、多くの酵素シグナル、例えばレジスチンを産生し、インスリン抵抗性と循環VLDL粒子濃度を増加させ、その結果LDL粒子濃度を増加させ、糖尿病の発症を促進させることがわかっている。
こちらも参照
- Catechin/ja
- Cholesterol/ja
- Lysosomal acid lipase deficiency/ja
- Cholesteryl ester storage disease/ja
- Coenzyme Q10/ja
- Flavonoid/ja
- Glutathione/ja
- Health effects of tea/ja
- High density lipoprotein/ja
- LDL receptor/ja
- Lipid profile/ja
- Lipoprotein(a)/ja
- Lipoprotein-X/ja
- Melatonin/ja
- Polyphenol antioxidant/ja
- Saturated fat/ja
- Stanol ester/ja
- Sterol ester/ja
- トリグリセリド
- Vitamin A/ja
- Vitamin C/ja
- Vitamin E/ja
外部リンク
- Fat (LDL) Degradation: PMAP The Proteolysis Map-animation
- Adult Treatment Panel III Full Report
- ATP III Update 2004
- O'Keefe JH, Cordain L, Harris WH, Moe RM, Vogel R (June 2004). "Optimal low-density lipoprotein is 50 to 70 mg/dL: lower is better and physiologically normal". Journal of the American College of Cardiology. 43 (11): 2142–6. doi:10.1016/j.jacc.2004.03.046. PMID 15172426.