アテローム性動脈硬化症
| アテローム性動脈硬化症 | |
|---|---|
| Other names | Arteriosclerotic vascular disease (ASVD) |
 | |
| 動脈硬化の進行(狭窄が誇張される) | |
| Specialty | 循環器学, angiology/ja |
| Symptoms | None |
| Complications | Coronary artery disease/ja, stroke/ja, peripheral artery disease/ja, kidney problems/ja |
| Usual onset | 若者(年齢とともに悪化する) |
| Causes | 飽和脂肪酸の蓄積、喫煙、高血圧、糖尿病 |
| Risk factors | High blood pressure/ja, diabetes/ja, smoking/ja, obesity/ja, ファミリーヒストリー, 不健康な食事(特にトランス脂肪酸)、慢性的なビタミンC不足 |
| Prevention | 健康的な食事、運動、禁煙、標準体重の維持 |
| Medication | Statin/ja, 血圧降下剤, aspirin/ja |
| Frequency | ≈100% (>65歳) |
アテローム性動脈硬化症は動脈硬化症の病型であり、動脈の壁に病変と呼ばれる異常が生じることを特徴とする。これらの病変は、アテローム性プラークの蓄積による動脈壁の狭小化につながることがある。発症時には通常症状はないが、発症した場合は一般に中年期頃から症状が始まる。重症になると、罹患した動脈が身体のどの部位にあるかによって、冠動脈疾患、脳卒中、末梢動脈疾患、腎障害を引き起こすことがある。
アテローム性動脈硬化症の正確な原因は不明であり、多因子性であると提唱されている。危険因子としては、コレステロール値異常、炎症性バイオマーカーの上昇、高血圧、糖尿病、喫煙(能動喫煙と受動喫煙の両方)、肥満、遺伝的因子、家族歴、生活習慣、不健康な食事などが挙げられる。アテロームは脂肪、コレステロール、カルシウム、および血液中に含まれる他の物質から構成されている。動脈が狭くなることで、酸素を豊富に含む血液が身体の一部に流れるのを制限する。診断は、身体検査、心電図、運動負荷試験などに基づいて行われる。
予防ガイドラインには、健康的な食事、運動、禁煙、正常体重の維持が含まれる。確立した疾患の治療には、スタチンなどのコレステロールを低下させる薬物療法、血圧治療薬、血栓形成のリスクを減らすための抗凝固療法などが含まれる。病状が進行すると、経皮的冠動脈インターベンション、冠動脈バイパス術、頸動脈内膜剥離術などの侵襲的な戦略が適用される。遺伝的要因もまた、この疾患プロセスに強く関与しており、完全に生活習慣の選択に基づくものではない。
アテローム性動脈硬化症は一般に若いときに始まり、加齢とともに悪化する。ほとんどすべての人が65歳までにある程度の影響を受ける。これは先進国における死因と障害の第一因である。この疾患は1575年に初めて報告されたが、その起源は200万年以上前、現生人類の祖先であるヒト科の祖先が進化する過程で起こったと思われる遺伝子変異にまでさかのぼり、この疾患状態は遺伝的に広く人類に固有のものであることを示唆する証拠がある。
徴候と症状
アテローム性動脈硬化症は何十年もの間無症状であるが、これは動脈がすべてのプラークの位置で拡大するため、血流に影響がないからである。ほとんどのプラーク破裂でさえ、血栓による動脈の十分な狭窄や閉鎖が起こるまでは症状を生じない。徴候や症状は、重度の狭窄や閉鎖によって、症状を誘発するのに十分なほどさまざまな臓器への血流が阻害された後に初めて生じる。ほとんどの場合、患者は脳卒中や心筋梗塞などの他の心臓血管障害を経験して初めて自分がこの病気にかかっていることに気づく。しかし、これらの症状は、どの動脈や臓器が冒されているかによって異なる。
初期のアテローム性動脈硬化症はおそらく小児期に始まる。子供の冠動脈では線維性病変やゼラチン性病変が観察されている。小児の冠動脈では脂肪縞が観察されている。冠動脈疾患は女性よりも男性に多くみられるが、脳動脈のアテローム性動脈硬化症や脳卒中は男女ともに同様に発症する。
心臓に酸素を含んだ血液を送る役割を担っている冠動脈の著しい狭窄は、狭心症の胸痛や息切れ、発汗、吐き気、めまいやふらつき、息苦しさや動悸などの症状を引き起こす。不整脈と呼ばれる心臓のリズム異常-心臓の拍動が遅すぎたり早すぎたりする-も虚血の結果である。
頸動脈は、脳と頸部に血液を供給している。頸動脈の狭窄が顕著になると、脱力感、考えがまとまらない、しゃべりにくい、めまい、歩行困難、まっすぐ立てない、目のかすみ、顔や手足のしびれ、激しい頭痛、意識障害などの症状が現れることがある。これらの症状は脳卒中(脳細胞の死)にも関係している。脳卒中は、脳に行く動脈の著しい狭窄や閉鎖によって引き起こされる。十分な血液が供給されないと、影響を受けた組織の細胞が死んでしまう。
脚、腕、骨盤に血液を供給する末梢動脈も、プラークの破裂や血栓のために著しい狭窄を経験する。狭窄の症状は、腕や脚のしびれや痛みである。プラーク形成のもう一つの重要な場所は、腎臓に血液を供給する腎動脈である。プラークの発生と蓄積は腎臓の血流低下と慢性腎臓病につながるが、これは他の部位と同様、一般的に末期になるまで無症状である。
2004年の米国のデータによると、男性の〜66%、女性の〜47%において、動脈硬化性心血管病の最初の症状は心臓発作または心臓突然死(症状発現から1時間以内の死亡と定義)であった。
事例研究としては、第二次世界大戦や朝鮮戦争で戦死した米兵の解剖がある。朝鮮戦争で戦死した300人の米軍兵士の剖検に関する報告がよく引用されている。兵士の平均年齢は22.1歳であったが、77.3パーセントに「冠動脈硬化の肉眼的証拠」があった。
危険因子

アテローム性動脈硬化の過程はよく理解されていない。アテローム性動脈硬化症は、低比重リポ蛋白(LDL)粒子の滞留に伴う血管壁の内皮細胞における炎症過程と関連している。この滞留は、基礎にある炎症過程の原因、影響、あるいはその両方である可能性がある。
プラークが存在すると、血管の筋肉細胞が伸張し、増加した嵩を補う。その後、内皮が厚くなり、プラークと内腔の間の隔たりが大きくなる。この肥厚はプラークの成長による狭窄をいくらか相殺するが、それ以上に、心拍動のたびに血管壁が硬くなり、伸張に対する抵抗性が低下する。
調整可能
- Western pattern diet/ja
- Abdominal obesity/ja
- インスリン抵抗性
- 糖尿病
- 脂質異常症
- 高血圧
- Trans fat/ja
- Tobacco smokingja
- Bacterial infections/ja
- HIV/AIDS/ja
調整不可
少ないか不確か
- Thrombophilia/ja
- Saturated fat/ja
- 過剰なcarbohydrate/ja
- triglycerides/jaの上昇
- Systemic inflammation/ja
- Hyperinsulinemia/ja
- Sleep deprivation/ja
- Air pollution/ja
- Sedentary lifestyle/ja
- Arsenic poisoning/ja
- アルコール
- Chronic stress/ja
- Hypothyroidism/ja
- Periodontal disease/ja
食事
食事脂肪と動脈硬化の関係については議論がある。米国農務省はフードピラミッドの中で、総カロリーの約64%を炭水化物とする食事を推奨している。アメリカ心臓協会、アメリカ糖尿病協会、全米コレステロール教育プログラムも同様の推奨をしている。対照的に、ウォルター・ウィレット教授(ハーバード公衆衛生大学院、第二次看護師健康調査のPI)は、脂肪、特に一価不飽和脂肪酸と多価不飽和脂肪酸のはるかに高いレベルを推奨している。しかし、これらの食事勧告はトランス脂肪の消費に対してコンセンサスを得ている。
ヒトにおいて、酸化した脂肪(腐敗脂肪)を食べることの役割は明らかではない。 腐敗した脂肪を与えられたウサギは動脈硬化を早く発症する。DHA含有油を与えられたラットは、その抗酸化系が著しく破壊され、かなりの量のリン脂質を蓄積した。血液、肝臓、腎臓にヒドロペルオキシドが蓄積した。
様々な油を含むアテローム食を与えたウサギは、多価不飽和油を介したLDLの酸化感受性が最も高いことが判明した。別の研究では、加熱した大豆油を与えたウサギは "肉眼的に動脈硬化を誘発し、組織学的および臨床的に顕著な肝障害が証明された"。しかし、Fred Kummerowは食事性コレステロールではなく、揚げ物や喫煙によるオキシステロール、つまり酸化コレステロールが原因であると主張している。
腐敗した油脂は少量でも非常に不味いので、人々は食べるのを避ける。 これらの物質の実際の消費量を測定したり推定したりすることは非常に難しい。魚油のような不飽和度の高いオメガ3を豊富に含む油は、錠剤の形で売られている場合、酸化したり腐ったりした脂肪の味を隠すことができる。米国では、健康食品業界の栄養補助食品は自主規制されており、FDAの規制の対象外である。不飽和脂肪酸を酸化から適切に守るには、酸素のない環境で冷却保存するのが最善である。
病態生理学
アテローム形成はアテローム斑の発生過程である。粥腫形成は、プラークと呼ばれる脂肪物質の内皮下蓄積につながる動脈のリモデリングによって特徴づけられる。粥腫性プラークの蓄積はゆっくりとしたプロセスであり、動脈壁内で起こる複雑な一連の細胞イベントと様々な局所的血管循環因子に反応して数年かけて進展する。最近のある仮説によると、理由は不明であるが、単球や好塩基球などの白血球が心筋の動脈内腔の内皮を攻撃し始める。続く炎症は、内皮と中膜の間に位置する血管壁の領域である動脈の内膜に粥腫性プラークを形成させる。これらの病変の大部分は余分な脂肪、コラーゲン、およびエラスチンでできている。最初、プラークが成長すると、壁の肥厚だけが起こり、狭窄は起こらない。狭窄は後発事象であり、一度も起こらないこともあり、多くの場合、アテローム性動脈硬化の過程そのものではなく、プラークの破裂と治癒反応が繰り返された結果である。
細胞
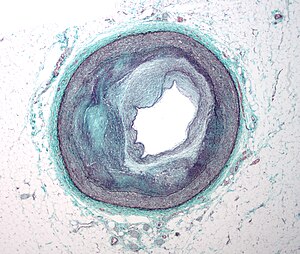
初期のアテローム形成は、血液中の単球(白血球の一種)が血管床の内壁である内皮に付着し、次いで内皮下腔に移動し、さらに単球由来のマクロファージに活性化することによって特徴づけられる。このプロセスの主要な促進因子として記録されているのは、内皮細胞の下にある壁内の酸化リポ蛋白粒子であるが、血中グルコースの正常または高濃度も大きな役割を果たしており、すべての要因が完全に解明されているわけではない。脂肪縞が現れたり消えたりすることがある。
血漿中の低比重リポ蛋白(LDL)粒子が内皮に侵入して酸化されると、心血管疾患のリスクが生じる。複雑な一連の生化学反応がLDLの酸化を制御しており、酵素(Lp-LpA2など)と内皮のフリーラジカルが関与している。
内皮への最初の損傷は炎症反応を引き起こす。単球が血流から動脈壁に侵入し、血小板が損傷部位に付着する。これは、循環単球をリクルートするVCAM-1や、単球のマクロファージへの分化に選択的に必要なM-CSFなどの因子の酸化還元シグナル誘導によって促進されると考えられる。単球はマクロファージに分化し、局所的に増殖し、酸化LDLを摂取し、ゆっくりと大きな「泡沫細胞」に変化する-細胞質内に多数の小胞があり、その結果脂質含量が高くなるため、その外観が変化することからこう呼ばれる。顕微鏡で見ると、病変は脂肪の筋のように見える。泡沫細胞は最終的に死滅し、炎症過程をさらに増殖させる。
これらの細胞活動に加えて、損傷した内皮細胞から分泌されるサイトカインに反応して、平滑筋の増殖と中膜から内膜への移動もみられる。これにより、脂肪縞を覆う線維性カプセルが形成される。無傷の内皮は一酸化窒素を放出することでこの平滑筋の増殖を防ぐことができる。
石灰化と脂質
石灰化は、周囲の筋層の血管平滑筋細胞の間、特に粥腫に隣接する筋細胞と粥腫プラークおよび組織の表面に形成される。やがて細胞が死滅すると、筋壁と粥腫プラークの外側部分との間に細胞外カルシウム沈着が生じる。粥腫性プラークがカルシウム沈着の調節を妨げることにより、カルシウムは蓄積し、結晶化する。 同様の形態の壁内石灰化は、動脈硬化の初期段階の様相を呈し、抗増殖作用の機序を持つ多くの薬剤によって誘発されるようである(Rainer Liedtke 2008)。
コレステロールは、コレステロールを含む低比重リポタンパク質(LDL)粒子によって血管壁に送り込まれる。マクロファージを引き付け刺激するためには、コレステロールがLDL粒子から放出され、酸化されなければならない。組織からコレステロールを除去して肝臓に運ぶリポ蛋白粒子である高密度リポ蛋白(HDL)が不足すると、このプロセスは悪化する。
泡沫細胞と血小板は平滑筋細胞の移動と増殖を促し、平滑筋細胞は脂質を摂取してコラーゲンに置換され、泡沫細胞そのものに変化する。通常、脂肪沈着と動脈内膜(内膜)の間には保護線維性被膜が形成される。
これらのキャップされた脂肪沈着物(現在では「アテローム」と呼ばれる)は、時間の経過とともに動脈を拡大させる酵素を産生する。粥腫の厚みを補うために動脈が十分に拡大する限り、開口部(「内腔」)の狭窄(狭窄)は起こらない。動脈は卵型の断面を持つように拡張するが、開口部は依然として円形である。拡大が粥腫の厚さに比例しない場合、動脈瘤が形成される。
目に見える特徴

動脈は通常顕微鏡的には研究されないが、2つのプラークタイプを区別することができる:
- 線維性脂質(線維性脂肪)プラークは、動脈の内膜の下に脂質を含んだ細胞が蓄積することを特徴とし、通常、動脈壁の境界筋層の代償膨張により内腔を狭めることはない。内皮の下には、プラークの粥腫性 "コア"を覆う "線維性被膜"がある。コアは、組織コレステロールおよびコレステロールエステル含量の上昇した脂質を含んだ細胞(マクロファージおよび平滑筋細胞)、フィブリン、プロテオグリカン、コラーゲン、エラスチン、および細胞屑からなる。 進行したプラークでは、プラークの中心核には通常、細胞外コレステロール沈着物(死んだ細胞から放出されたもの)があり、空洞のある針状の裂け目を持つコレステロール結晶の領域を形成する。プラークの周辺部には若い "泡状 "細胞と毛細血管がある。これらのプラークが破裂すると、通常患者に最も大きなダメージを与える。コレステロールの結晶も一役買っている可能性がある。
- 線維性プラークはまた、内膜の下、動脈壁内に局在し、壁の肥厚と拡張をもたらし、時には、筋層の若干の萎縮を伴う内腔の局所的な狭小化を生じる。線維性プラークには、コラーゲン線維(好酸球)、カルシウムの沈殿物(ヘマトキシリン好酸球)、およびまれに脂質を含む細胞が含まれる。
事実上、動脈壁の筋肉部分は、存在するアテロームを保持するのに十分な大きさの小さな動脈瘤を形成する。動脈壁の筋肉部分は、アテローム斑を補うためにリモデリングした後でも、通常は強いままである。
しかし、血管壁内のアテロームは柔らかくもろく、弾力性に乏しい。動脈は心拍、すなわち脈拍のたびに絶えず拡張と収縮を繰り返す。さらに、粥腫の外側部分と筋肉壁の間に石灰化が沈着し、それが進行すると、動脈全体の弾力性が失われ硬くなる。
石灰沈着が十分に進行した後では、冠動脈コンピュータ断層撮影または電子線断層撮影(EBT)において、動脈壁内の粥腫性プラークの外縁の周囲にハローを形成するX線密度の増加したリングとして部分的に可視化される。CTでは、ハウンスフィールドスケールで130単位以上(90単位とする意見もある)が、動脈内の組織石灰化を明確に示すものとして通常受け入れられているX線撮影密度である。これらの沈着物は、血管造影では動脈の内腔がまだ正常であることが多いにもかかわらず、比較的進行した疾患の明白な証拠を示している。
破裂と狭窄

この疾患は数十年かけてゆっくりと進行する傾向があるが、アテロームが潰瘍化するまで無症状のままであることが多く、アテロームの潰瘍部位で直ちに血液凝固が起こる。 これは、血栓の肥大につながる事象のカスケードを引き起こし、血液の流れを急速に阻害する可能性がある。完全な閉塞は心筋の虚血と損傷につながる。 この過程が心筋梗塞または「心臓発作」である。
心臓発作が致命的でない場合、内腔内の血栓の線維性組織化が起こり、破裂を覆うが、同時に狭窄または内腔の閉鎖を生じる。狭窄は緩徐に進行することがあるが、プラーク潰瘍は「不安定」になったより薄い/より弱い線維性被膜を持つアテロームで特に起こる突発的な事象である。
プラークの破裂が繰り返され、内腔の完全な閉鎖に至らないものは、破裂部上の血栓パッチと血栓を安定化させる治癒反応との組み合わせにより、時間の経過とともにほとんどの狭窄が生じる。狭窄部では流速が増加するにもかかわらず、狭窄部はより安定化する傾向がある。ほとんどの主要な血流停止現象は大きなプラークで起こるが、そのプラークは破裂前は狭窄を生じることはあってもほとんどなかった。
臨床試験から,その後破裂して動脈が完全に閉塞するプラークの平均狭窄度は20%である。ほとんどの重篤な臨床事象は高度の狭窄を生じるプラークでは起こらない。臨床試験から,心臓発作の14%だけが,血管閉鎖前に75%以上の狭窄を生じたプラークでの動脈閉鎖によって起こっている。
動脈内で軟性アテロームと血流を隔てている線維性被膜が破裂すると、組織片が露出して放出される。これらの組織片はコラーゲンと組織因子を含む非常に血栓促進性の高いものであり、血小板を活性化し、凝固系を活性化する。その結果、粥腫の上に血栓(血の塊)が形成され、急性的に血流が阻害される。血流障害により、下流の組織は酸素と栄養が不足する。これが心筋(心臓の筋肉)であれば、狭心症(心臓の胸痛)や心筋梗塞(心臓発作)が発症する。
プラークの成長促進
動脈硬化性プラークの動脈内皮の一部における分布は不均一である。動脈硬化性変化の多発的かつ局所的な進展は、脳のアミロイド斑の進展や皮膚の加齢斑の進展と類似している。誤修復-蓄積老化説は、動脈硬化の局所的な進展において、誤修復メカニズムが重要な役割を果たしていることを示唆している。プラークの形成は傷ついた内皮の修復の結果である。内皮下に脂質が注入されるため、修復は局所的な内皮のリモデリングの変化によって終了せざるを得ない。これは誤った修復の現れである。重要なことは、この変化したリモデリングによって、局所内皮の損傷に対する脆弱性が増大し、修復効率が低下することである。その結果、内皮のこの部分は傷害を受け、不適切に修復される危険因子が増加する。このように、内皮の修復不良の蓄積は局所化し、自己加速的に進行する。このように、プラークの成長もまた自己加速的である。動脈壁の一部では、最も古いプラークが常に最も大きく、局所的な動脈の閉塞を引き起こす最も危険なプラークである。
構成要素
プラークは3つの異なる構成要素に分けられる:
- アテローム(「粥の塊」、 from Greek ἀθήρα (athera) 'gruel')は、動脈の内腔に最も近いマクロファージで構成される大きなプラークの中心にある、柔らかく薄片状の黄色っぽい物質の結節状の蓄積である。
- その下にはコレステロール結晶がある。
- 古い病変や進行した病変の外側基部の石灰化。アテローム性動脈硬化病変(アテローム性プラーク)は2つのカテゴリーに大別される: 安定型と不安定型(脆弱型とも呼ばれる)である。アテローム性動脈硬化病変の病態生物学は非常に複雑であるが、一般に無症状の傾向がある安定型アテローム性動脈硬化プラークは、細胞外マトリックスと平滑筋細胞に富んでいる。一方、不安定プラークはマクロファージと泡沫細胞に富み、病変部と動脈内腔を隔てる細胞外マトリックス(線維性被膜とも呼ばれる)は通常弱く、破裂しやすい。線維性被膜の破裂により、コラーゲンなどの血栓形成物質が循環に曝露され、最終的に内腔での血栓形成を誘発する。形成されると、管腔内血栓は動脈を完全に閉塞させることもあるが(冠動脈閉塞など)、より多くの場合、血栓は剥離して循環中に移動し、最終的には下流の小さな枝を閉塞させて血栓塞栓症を引き起こす。
血栓塞栓症とは別に、慢性的に拡大したアテローム性動脈硬化病変は内腔の完全な閉鎖を引き起こすことがある。慢性的に拡大した病変は、内腔の狭窄がひどく(通常は80%以上)、下流の組織への血液供給が不十分となり、虚血に至るまで無症状であることが多い。進行したアテローム性動脈硬化症のこれらの合併症は慢性的で、ゆっくりと進行し、累積する。最も一般的なのは、軟らかいプラークが突然破裂し(脆弱プラークを参照)、血栓の形成を引き起こし、血流を急速に減速または停止させ、動脈から血液を供給されている組織を約5分で死に至らしめることである。この現象は梗塞と呼ばれる。
診断

血管造影法や,それほどではないが「ストレス試験」によって検出可能な重度の狭窄領域は,一般的に心血管系疾患に対するヒトの診断技術の焦点となってきた。しかし,これらの方法は重度の狭窄のみを検出することに重点を置いており,根本的な動脈硬化疾患を検出するものではない。ヒトの臨床研究によって実証されたように,ほとんどの重篤なイベントはプラークの多い場所で起こるが,衰弱するようなイベントが突然起こる前には,内腔の狭窄はほとんどあるいは全く存在しない。プラークの破裂は数秒から数分で動脈内腔の閉塞を引き起こし、永久的な衰弱、時には突然死をもたらす可能性がある。
破裂したプラークは複雑病変と呼ばれる。病変部の細胞外マトリックスは、通常、病変部と動脈内腔を隔てる線維性被膜の肩部で破断し、そこで露出したプラークの血栓形成性成分、主にコラーゲンが血栓形成の引き金となる。その後、血栓は下流の他の血管に移動し、そこで血栓は部分的あるいは完全に血流を遮断する。血流が完全に遮断されると、近傍の細胞への酸素供給が不足するために細胞死が起こり、壊死が生じる。血流の狭窄または閉塞は、体内のどの動脈でも起こりうる。心筋を供給する動脈の閉塞は心臓発作を引き起こし、脳を供給する動脈の閉塞は虚血性脳卒中を引き起こす。

狭窄が75%を超えると、狭心症の再発や負荷試験での異常が狭窄の重症度によってのみ検出されるため、以前は臨床的に重要な疾患の特徴であると考えられていた。 しかし、臨床試験によると、75%以上の狭窄部位では臨床的に衰弱させるイベントの約14%しか起こらないことが示されている。粥腫プラークの突然の破裂を伴う心血管系イベントの大部分は、内腔の明らかな狭窄を示さない。 そのため、1990年代後半から "脆弱プラーク"が注目されるようになった。
血管造影や負荷試験などの伝統的な診断法のほかに,動脈硬化性疾患を早期に発見するための他の検出法も過去数十年の間に開発されてきた。検出手法には解剖学的検出や生理学的測定などがある。
解剖学的検出法の例としては、CTによる冠動脈カルシウムスコアリング、超音波による頸動脈IMT(内膜中膜厚)測定、および血管内超音波(IVUS)が挙げられる。 生理学的測定法の例としては、リポ蛋白サブクラス分析、HbA1c、hs-CRP、ホモシステインなどがある。解剖学的手法と生理学的手法の両方により、症状が現れる前の早期発見、疾患の病期分類、疾患の進行の追跡が可能となる。解剖学的方法はより高価であり、IVUSのように侵襲的なものもある。一方、生理学的検査法は安価で安全であることが多い。しかし、病気の現在の状態を定量化したり、進行を直接追跡したりすることはできない。近年、PETやSPECTなどの核医学イメージング技術の発展により、動脈硬化性プラークの重症度を推定する方法が提供されている。
予防
確立された危険因子を回避すれば、心血管疾患の90%までは予防可能である。アテローム性動脈硬化症の医学的管理には、まず禁煙や食事制限などの危険因子の修正が必要である。 予防は一般的に、健康的な食事、運動、禁煙、正常体重の維持である。
食事療法
食生活の変化は動脈硬化の発症予防に役立つ可能性がある。暫定的な証拠によると、乳製品を含む食事は心血管系疾患のリスクに影響を及ぼさないか、またはリスクを低下させる。
野菜と果物を多く含む食事は、心血管疾患と死亡のリスクを減少させる。地中海食が心血管系の結果を改善する可能性があることを示唆するエビデンスがある。また、心血管危険因子の長期的な変化(例えば、コレステロール値や血圧の低下)をもたらす上で、地中海食は低脂肪食よりも優れているかもしれないという証拠もある。
運動
管理された運動プログラムは、血管の循環と機能性を改善することによって動脈硬化と闘う。運動は肥満患者の体重管理、血圧低下、コレステロール低下にも用いられる。多くの場合、生活習慣の改善は薬物療法と組み合わされる。例えば、スタチン系薬剤はコレステロールを低下させる。アスピリンのような抗血小板薬は血栓の予防に役立ち、さまざまな降圧薬は血圧をコントロールするために日常的に使用される。 危険因子の改善と薬物療法を組み合わせても、症状のコントロールや虚血性イベントの差し迫った脅威と闘うのに十分でない場合、医師は閉塞を改善するためにインターベンションや外科的処置に頼ることがある。
治療
確立された疾患の治療には、スタチンなどのコレステロールを低下させる薬、血圧の薬、またはアスピリンなどの血液凝固を減少させる薬が含まれる。また、経皮的冠動脈インターベンション、冠動脈バイパス術、頸動脈内膜剥離術などの手技が行われることもある。
医学的治療はしばしば症状の緩和に焦点を当てる。しかし、単に症状を治療するのではなく、根本的な動脈硬化を改善することに重点を置いた治療法がより効果的である。通常、禁煙や定期的な運動など、非薬物療法が最初の治療法となる。これらの方法で効果がない場合は、通常、医薬品が心血管疾患の治療における次のステップであり、改善されるにつれて、長期的に最も効果的な方法となりつつある。
より効果的なアプローチの鍵は、複数の異なる治療戦略を組み合わせることである。さらに、リポ蛋白の輸送行動など、最も成功率が高いとされているアプローチでは、より積極的な治療戦略を組み合わせて毎日、無期限に行うことで、症状が出る前も、特に症状が出た後も、一般的に良い結果が得られている。
スタチン
スタチンと呼ばれる薬物群は、アテローム性動脈硬化症の治療薬として広く処方されている。これらは、高コレステロールの患者において、副作用がほとんどなく、心血管疾患および死亡率の減少に有益であることを示している。冠動脈疾患、虚血性脳卒中、末梢動脈疾患の再発を予防するために、ASCVD(アテローム性動脈硬化性心血管疾患)の既往歴のあるすべての患者に対して、高強度スタチンとアスピリンを含む二次予防療法が複数の学会のガイドラインで推奨されている。しかし、これらのガイドラインに沿った治療法の処方とその遵守は、特に若年患者と女性において不十分である。
スタチンは、コレステロールの生化学的生産経路における肝の律速酵素であるHMG-CoA(ヒドロキシメチルグルタリルコエンザイムA)還元酵素を阻害することによって作用する。この律速酵素を阻害することで、体内でコレステロールを内因性に生産することができなくなり、血清LDL-コレステロールが減少する。この内因性コレステロール産生の減少により、体内では他の細胞源からコレステロールが引き出され、血清HDL-コレステロールが増加する。これらのデータは主に中年男性を対象としたもので、女性や70歳以上の人については結論はあまり明確ではない。
手術
動脈硬化が重症化し、末梢動脈疾患の場合の組織喪失などの不可逆的な虚血を引き起こした場合、手術が適応となることがある。血管バイパス手術は動脈の病変部周辺の流れを再確立することができ、ステント留置の有無にかかわらず血管形成術は狭窄した動脈を再開通させ血流を改善することができる。上行大動脈を操作しない冠動脈バイパス移植術は、従来のオンポンプ冠動脈血行再建術と比較して、術後の脳卒中および死亡率が減少することが実証されている。
その他
一部の抗凝固薬、特にワルファリンは、ビタミンKの代謝を阻害することによって血栓形成を阻害するが、短期的には血栓形成を減少させるにもかかわらず、長期的には実際に動脈石灰化を促進するという証拠がある。また、3-ヒドロキシベンズアルデヒドやプロトカテクアルデヒドなどの低分子は、動脈硬化のリスクを減少させる血管保護効果を示している。
疫学
心血管系疾患は主に動脈硬化の臨床症状であり、世界的な主要死因の一つである。
先進国では10歳以上のほとんどすべての小児に大動脈脂肪縞があり、冠循環脂肪縞は思春期から始まる。
1953年、朝鮮戦争で死亡した米兵300人の剖検結果を調べた研究が発表された。兵士たちの平均年齢はわずか22歳であったにもかかわらず、その77%に冠動脈硬化の兆候が見られた。この研究は、心臓病が若い年齢でも発症する可能性があり、高齢者だけの問題ではないことを示した。
1992年には、10~14歳の小児の50%以上で左前下行動脈に顕微鏡的な脂肪の筋が認められ、8%では細胞外脂質の蓄積がさらに進んだ病変であったという報告があった。
1985年から1995年にかけて行われた研究の2005年の報告では、5歳から14歳の大動脈の約87%と冠動脈の約30%に脂肪筋があり、年齢とともに増加することが判明した。
語源
以下の用語はスペルも意味も似ているが区別され、混同されやすい: 動脈硬化、動脈硬化症、アテローム性動脈硬化症である。 動脈硬化とは、中・大動脈(from Greek ἀρτηρία (artēria) 'artery', and σκλήρωσις (sklerosis) 'hardening'); arteriolosclerosisはarteriole(細動脈)の硬化(および弾力性の喪失)である; 「アテローム性動脈硬化症」とは、特にアテローム性プラーク(from Ancient Greek ↪Ll_100θήρα (athl_1E17ra) 'gruel')に起因する動脈の硬化である。アテロームの形成を引き起こす物質またはプロセスに対してアテローム誘発性という用語が用いられる。
経済
2011年、冠動脈硬化症は、米国における入院治療費の最も高い疾患トップ10の1つであり、その総額は104億ドルに達した。
研究
脂質
動脈硬化に対する高密度リポタンパク質(HDL)の役割については、このHDLタンパク質のまれなApo-A1ミラノヒト遺伝子変異体が示唆されている。細菌によって合成されたヒトApo-A1ミラノを用いた小規模の短期試験が行われた。不安定狭心症の患者にHDLを投与したところ、わずか6週間で冠動脈プラーク体積の測定値がかなり劇的に減少した。この試験は2006年初めにJAMAに発表された。 1990年代に始まった進行中の研究は、おそらく2008年頃までにはヒトでの臨床試験につながる可能性がある。これらの臨床試験には、合成されたApo-A1ミラノHDLが直接使われるかもしれないし、遺伝子導入法を用いてApo-A1ミラノHDLリポ蛋白の合成能力を渡すかもしれない。
いくつかの動物実験では、HDL粒子濃度を増加させることで、アテロームがほぼ逆転し、除去される方法が開発・研究されている。しかし、どのような方法でもHDLを増加させることが必ずしも有用であるとは限らない。例えば、トルセトラピブという薬剤は、現在知られている中でHDLを増加させる最も効果的な薬剤である(最大60%)。しかし、臨床試験では死亡率も60%上昇した。 この薬に関するすべての研究は2006年12月に中止された。
マクロファージの作用はアテローム性動脈硬化プラークの進行を促進する。 動脈硬化の免疫調節とは、このマクロファージの作用を抑制するために免疫系の機能を調節する技術を指す。
アテローム形成における脂質過酸化連鎖反応の関与は、通常のPUFA(H-PUFA)よりも酸化されにくい重同位体(重水素化)多価不飽和脂肪酸(D-PUFA)の保護的役割に関する研究の引き金となった。PUFAは必須栄養素であり、食物とともに摂取されるため、まさにその形で代謝に関与している。ヒトのようなリポタンパク質代謝のモデルであるトランスジェニックマウスでは、食事にD-PUFAを加えると、確かに体重増加が減少し、コレステロールの取り扱いが改善され、大動脈のアテローム性動脈硬化性損傷が減少した。
miRNA
マイクロRNA(miRNA)は、タンパク質コード遺伝子の標的mRNAの3' UTRと5' UTRに相補的な配列を持ち、mRNAの切断や翻訳機構の抑制を引き起こす。疾患のある血管では、miRNAは調節異常で高発現している。miR-33は心血管疾患において見出される。miR-33は、脂質代謝、インスリンシグナル伝達経路およびグルコース恒常性、細胞型の進行と増殖、および骨髄球分化を含むアテローム性動脈硬化の開始と進行に関与している。ネズミにおいて、miR-33を阻害するとHDL値が上昇すること、またヒトの動脈硬化性プラークではmiR-33の発現が低下していることが明らかにされている。
miR-33aとmiR-33bは、22番染色体のヒトステロール調節エレメント結合タンパク質2(SREBP2)遺伝子のイントロン16と、17番染色体のSREBP1遺伝子のイントロン17に存在する。miR-33a/bは、ATP結合カセット(ABC)トランスポーターなどのコレステロール輸送に関与する遺伝子の3'UTRに結合し、その発現を亢進または抑制することにより、コレステロール/脂質の恒常性を調節する。研究により、ABCA1が末梢組織からアポリポ蛋白-1へのコレステロール輸送を仲介していること、また、コレステロールが末梢組織から肝臓に運ばれ、そこで胆汁に排泄されるか、排泄前に胆汁酸に変換される逆コレステロール輸送経路においても重要であることが示されている。したがって、ABCA1がマクロファージにおけるコレステロール蓄積の防止に重要な役割を果たしていることが分かっている。miR-33の機能を増強することにより、ABCA1のレベルが低下し、アポA-1への細胞内コレステロール排出が減少する。一方、miR-33の機能を阻害すると、ABCA1のレベルが上昇し、apoA-1へのコレステロール排出が増加する。miR-33の抑制は、ABCA1の発現調節を介して、細胞内コレステロールの減少と血漿HDLレベルの上昇をもたらす。研究により、ABCA1が末梢組織からアポリポ蛋白質-1へのコレステロール輸送を仲介していること、また、コレステロールが末梢組織から肝臓に運ばれ、そこで胆汁に排泄されるか、排泄前に胆汁酸に変換される逆コレステロール輸送経路においても重要であることが示されている。したがって、ABCA1がマクロファージにおけるコレステロール蓄積の防止に重要な役割を果たしていることが分かっている。miR-33の機能を増強することにより、ABCA1のレベルが低下し、アポA-1への細胞内コレステロール排出が減少する。一方、miR-33の機能を阻害すると、ABCA1のレベルが上昇し、apoA-1へのコレステロール排出が増加する。miR-33の抑制は、ABCA1の発現調節を介して、細胞内コレステロールの減少と血漿HDLレベルの上昇をもたらす。
このシクロデキストリンという糖は、高脂肪食を与えたマウスの動脈に蓄積したコレステロールを除去した。
DNA損傷
加齢は心血管障害の最も重要な危険因子である。 他の危険因子とは別に、加齢がその影響を媒介する原因的基盤はまだ明らかにされていない。 血管の老化においてDNA損傷が重要な役割を果たすという証拠がレビューされている。8-oxoGは、DNAにおける酸化的損傷の一般的なタイプであり、プラーク血管平滑筋細胞、マクロファージ、内皮細胞に蓄積することが分かっており、DNA損傷とプラーク形成が関連している。DNA鎖切断もアテローム性動脈硬化プラークで増加している。 ウェルナー症候群(WS)は、ヒトの早老症である。 WSは、DNAから損傷を除去するいくつかの修復プロセスに関与するRecQヘリカーゼの遺伝子欠損によって引き起こされる。 WS患者は、冠動脈および大動脈にかなりの動脈硬化性プラークを生じ、大動脈弁の石灰化も頻繁に観察される。 大動脈弁の石灰化もしばしば観察される。これらの所見は、修復されない過剰なDNA損傷と早期老化および早期のアテローム性動脈硬化プラーク発生とを結びつけている(老化のDNA損傷説を参照)。
微生物
体内にある全ての微生物からなる細菌叢は、様々な方法で動脈硬化に寄与する可能性がある: 免疫系の調節、代謝の変化、栄養素の処理、そして血液循環に入る特定の代謝産物の生成など。そうした代謝産物の一つに、腸内細菌が生成するトリメチルアミンN-オキシド(TMAO)がある。 TMOAの濃度レベルは、ヒトの研究において動脈硬化と関連があることが示されており、動物実験では因果関係がある可能性が示唆されている。 TMAOの生成に関与する酵素であるトリメチルアミンリアーゼをコードする細菌遺伝子とアテローム性動脈硬化症との関連も指摘されている。
血管平滑筋細胞
血管平滑筋細胞はアテローム形成において重要な役割を果たし、歴史的には、保護線維性被膜を形成し、強度を与える細胞外マトリックス成分を合成することによって、プラークの安定性に有益であると考えられてきた。しかしながら、線維性被膜に加えて、血管平滑筋細胞はプラークコア内に見られる多くの細胞タイプを生み出し、プラークの安定性を促進したり低下させたりするためにその表現型を変化させることができる。血管平滑筋細胞はアテローム性動脈硬化プラーク内で顕著な可塑性を示し、マクロファージ、筋線維芽細胞、間葉系幹細胞、骨軟骨細胞などの様々な他の細胞型に類似するように遺伝子発現プロファイルを変化させることができる。重要なことは、遺伝子系統追跡実験によって、プラーク常在細胞の40-90%が血管平滑筋細胞由来であることが明確に示されたことである。したがって、新しい治療標的を同定するためには、動脈硬化における血管平滑筋細胞の役割を研究することが重要である。
外部リンク
 Quotations related to Atherosclerosis at Wikiquote
Quotations related to Atherosclerosis at Wikiquote- Atherosclerosis/ja at Curlie
- Atherosclerosis pathophysiology-stages and types