オメガ-3脂肪酸エチルエステル
Omega-3 acid ethyl esters/ja
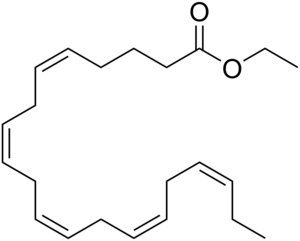 重要なオメガ3酸エチルエステルであるイコサペンタエン酸エチルの化学構造 | |
| Combination of | |
|---|---|
| Eicosapentaenoic acid | 抗脂血症剤 |
| Docosahexaenoic acid | 抗脂血症剤 |
| Clinical data | |
| Trade names | Lovaza, Omtryg, others |
| AHFS/Drugs.com | Monograph |
| License data | |
| Pregnancy category |
|
| Routes of administration | By mouth/ja |
| ATC code |
|
| Legal status | |
| Legal status | |
| Identifiers | |
| CAS Number | |
| DrugBank | |
| UNII | |
| KEGG | |
オメガ3酸エチルエステルとは、オメガ3脂肪酸のエチルエステルであるイコサペンタエン酸エチルとドコサヘキサエン酸エチルの混合物である。魚油に含まれるイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)のエチルエステルである。食生活の改善とともに、これらは高血中トリグリセリドの治療に用いられ、膵炎のリスクを低下させる可能性がある。一般的にスタチンよりも好まれず、NHSスコットランドでは心臓病のリスク低下を支持するエビデンスがないため、使用は推奨されていない。
一般的な副作用には、げっぷ、吐き気、腹部のむかつきなどがある。重篤な副作用としては、肝臓障害やアナフィラキシーがある。妊娠中の使用は十分に研究されていないが、いくつかのオメガ3脂肪酸は有益と思われる。どのように作用するかは完全には明らかになっていない。
オメガ3酸エチルエステル医薬品は、EUでは2000年に、米国では2004年に医療用として承認された。オメガ-3酸エチルエステルは、処方箋による先発医薬品のほか、ジェネリック医薬品や市販薬としても販売されている。2021年には、米国で最も処方されている医薬品の第218位で、処方件数は1 万件を超えた。
医学利用
オメガ-3酸エチルエステルは、重度(≧500 mg/dL)の高トリグリセリド血症の成人において、トリグリセリド値を低下させるために、食事の変更に加えて使用される。欧州連合および米国以外の他の主要市場では、オメガ-3酸エチルエステルは単独で高トリグリセリド血症に、または混合型脂質異常症の患者に対してはスタチンとの併用が適応となっている。
長鎖オメガ-3脂肪酸を処方薬や栄養補助食品として大量(2.0~4.0g/日)に摂取することは、一般的にトリグリセリドを有意に(15%以上)低下させるために必要であり、そのような摂取量では、その効果は有意(20%~35%、500 mg/dLを超える人では45%まで)である可能性がある。 イコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)はともにトリグリセリドを低下させるが、DHAはEPAよりもLDLコレステロールを上昇させ、DHAはHDLコレステロールを上昇させるがEPAは上昇させないようである。
他の魚油ベースの薬物
市販されている他のオメガ3系魚油ベースの処方薬物にも、同様の用途と作用機序がある。
- イコサペンタエン酸エチル(バセパ)。EPAのみのエチルエステル。
- オメガ3カルボン酸(Epanova)。この製品には遊離脂肪酸が含まれており、エチルエステルではない。現在、製造元(アストラゼネカ社)により販売中止となっており、患者は入手できない。アストラゼネカ社は第3相臨床試験を無益であるとして自主的に中止した。
栄養補助食品
多くの魚油サプリメントが市販されている。オメガ3系脂肪酸のトリグリセリド低下作用については、栄養補助食品と処方薬の間にほとんど差はないようだが、エチルエステル製品は空腹時や低脂肪食と一緒に摂取すると効果が低下する。栄養補助食品の成分は、処方薬ほど注意深く管理されておらず、薬物のような臨床試験も行われていない。処方されるオメガ3系サプリメントは、より濃縮されているため、同じ1日摂取量を摂取するのに必要なソフトジェルの数が少なくてすむ。
血液透析を必要とするCKD患者では、血液凝固による血管閉塞によって透析療法ができなくなる危険性がある。オメガ3脂肪酸は、血液凝固を抑えるエイコサノイド分子の産生に寄与する。しかし、2018年に行われたコクランレビューでは、オメガ3サプリメントがCKD患者の血管閉塞予防に何らかの影響を与えるという明確な証拠は見つからなかった。また、サプリメントは12ヵ月以内の入院や死亡を予防しないという中程度の確実性もあった。
Side effects
Special caution should be taken with people who have fish and shellfish allergies. In addition, as with other omega-3 fatty acids, taking omega-3 acid ethyl esters puts people who are on anticoagulants at risk for prolonged bleeding time.
Side effects include stomach ache, burping, and a bad taste; some people on very high doses (8g/day) in clinical trials had atrial fibrillation.
Omega-3 acid ethyl esters have not been tested in pregnant women and are rated pregnancy category C; it is excreted in breast milk and the effects on infants are not known.
Pharmacology
After ingestion, omega-3-acid ethyl esters are metabolized mostly in the liver like other dietary fatty acids.
Mechanism of action
Omega-3-acid ethyl esters, like other omega-3 fatty acid-based drugs, appears to reduce production of triglycerides in the liver and to enhance clearance of triglycerides from circulating very low-density lipoprotein (VLDL) particles. The way it does that is not clear, but potential mechanisms include increased breakdown of fatty acids; inhibition of diglyceride acyltransferase, which is involved in biosynthesis of triglycerides in the liver; and increased activity of lipoprotein lipase in blood. The synthesis of triglycerides is reduced in the liver because EPA and DHA are poor substrates for the enzymes responsible for triglyceride synthesis.
Physical and chemical properties
The active ingredient is concentrated omega-3 acid ethyl esters that are made from fish body oils that are purified and esterified. For the Lovaza product, each 1000 mg softgel capsule contains 840 mg omega-3 fatty acids: eicosapentaenoic acid ethyl ester (460 mg) and docosahexaenoic acid ethyl ester (380 mg).
History
Pronova BioPharma ASA had its roots in Norway's codfish liver oil industry. The company was founded in 1991 as a spinout from the JC Martens company, which in turn was founded in 1838 in Bergen, Norway. Pronova developed the concentrated omega-3-acid ethyl esters formulation that is the active pharmaceutical ingredient of Lovaza.
Pronova won approvals to market the drug, called Omacor in Europe (and initially in the US), in several European countries in 2001 after conducting a three and a half year trial in 11,000 subjects; The company partnered with other companies like Pierre Fabre in France. In 2004, Pronova licensed the US and Puerto Rican rights to Reliant Therapeutics, whose business model was in-licensing of cardiovascular drugs. In that same year, Reliant and Pronova won FDA approval for the drug, and it was launched in the US and Europe in 2005. Global sales in 2005 were $144M, and by 2008, they were $778M. In 2007 GlaxoSmithKline acquired Reliant for $1.65 billion in cash.
In 2009, generic companies Teva Pharmaceuticals and Par Pharmaceutical made clear their intentions to file Abbreviated New Drug Applications ("ANDAs") to bring generics to market, and in April 2009, Pronova sued them from infringing the key US patents covering Lovaza, US 5,656,667 (due to expire in April 2017), US 5,502,077 (exp March 2013). Subsequently, in May 2012, a district court ruled in Pronova's favor, saying that the patents were valid. The generic companies appealed, and in September 2013, the Federal Circuit reversed, saying that because more than one year before Pronova's predecessor company applied for a patent, it had sent samples of the fish oil used in Lovaza to a researcher for testing. This event thus constituted "public use" that invalidated the patent in question. Generic versions of Lovaza were introduced in America in April 2014.
Pronovo has continued to manufacture the ingredients in Lovaza, and in 2012, BASF announced it would acquire Pronova for $844 million. The deal closed in 2013.
ブランド名
- ロバザ(米国)/オマコール(欧州)。米国では2004年に承認されている。
- OmtrygはTrygg Pharma社が開発したオメガ3酸エチルエステルの別ブランドで、2004年にFDAに承認された。
- 2016年3月現在、さらに4つのジェネリック医薬品がある。