Discovery and development of dipeptidyl peptidase-4 inhibitors/ja: Difference between revisions
Created page with "thumb|450px|'''図6:'''シアノピロリジン類の基本構造とビルダグリプチン、サキサグリプチン、デナグリプチンとの比較 Bristol-Myers Squibbの研究者たちは、''N''末端のアミノ酸側鎖の立体バルクを増加させることで安定性が増すことを発見した。さらに安定性を高めるため..." Tags: Mobile edit Mobile web edit |
No edit summary Tags: Mobile edit Mobile web edit |
||
| (26 intermediate revisions by the same user not shown) | |||
| Line 17: | Line 17: | ||
'''図1:''''[[meal/ja|食事]]中に、[[incretin/ja|インクレチン]]である[[glucagon-like peptide 1/ja|グルカゴン様ペプチド1]](GLP-1)とグルコース依存性[[gastric inhibitory polypeptide/ja|胃抑制ポリペプチド]](GIP)が[[small intestine/ja|小腸]]から血液中に放出される。これらの[[hormone/ja|ホルモン]]はグルコース依存的にインスリン分泌を調節する。(GLP-1は[[human body/ja|人体]]において多くの役割を持っている。インスリンの生合成を刺激し、グルカゴンの分泌を抑制し、胃排出を遅らせ、食欲を減退させ、膵島[[beta cell/ja|β-cell]]の再生を刺激する) | '''図1:''''[[meal/ja|食事]]中に、[[incretin/ja|インクレチン]]である[[glucagon-like peptide 1/ja|グルカゴン様ペプチド1]](GLP-1)とグルコース依存性[[gastric inhibitory polypeptide/ja|胃抑制ポリペプチド]](GIP)が[[small intestine/ja|小腸]]から血液中に放出される。これらの[[hormone/ja|ホルモン]]はグルコース依存的にインスリン分泌を調節する。(GLP-1は[[human body/ja|人体]]において多くの役割を持っている。インスリンの生合成を刺激し、グルカゴンの分泌を抑制し、胃排出を遅らせ、食欲を減退させ、膵島[[beta cell/ja|β-cell]]の再生を刺激する) | ||
GLP-1とGIPは、[[enzyme/ja|酵素]]DPP-4によって触媒される非常に速い不活性化により、血漿[[half-lives/ja|半減期]]が極めて短い。DPP-4である。DPP-4を阻害すると、これらの不活性化が遅くなり、作用が増強され、血漿中のグルコース濃度が低下するので、2型糖尿病の治療に有用である。(図1) | |||
GLP-1とGIPは、[[enzyme/ja|酵素]]DPP-4によって触媒される非常に速い不活性化により、血漿[[half-lives/ja|半減期]]が極めて短い。DPP-4である。DPP- | |||
===DPP-4の分布と機能=== | ===DPP-4の分布と機能=== | ||
| Line 91: | Line 89: | ||
=====サキサグリプチン===== | =====サキサグリプチン===== | ||
[[File:Structure of cyanopyrrolidine DPP-4 inhibitors.svg|thumb|450px|'''図6:'''シアノピロリジン類の基本構造とビルダグリプチン、サキサグリプチン、デナグリプチンとの比較]] | [[File:Structure of cyanopyrrolidine DPP-4 inhibitors.svg|thumb|450px|'''図6:'''シアノピロリジン類の基本構造とビルダグリプチン、サキサグリプチン、デナグリプチンとの比較]] | ||
[[Bristol-Myers Squibb]]の研究者たちは、''N''末端の[[amino acid/ja|アミノ酸]][[Side chain/ja|側鎖]]の[[steric bulk/ja|立体バルク]]を増加させることで安定性が増すことを発見した。さらに安定性を高めるために、''トランス''-[[rotamer/ja|ロータマー]]は[[pyrrolidine/ja|ピロリジン]]環の''シス''-4,5- | [[Bristol-Myers Squibb]]の研究者たちは、''N''末端の[[amino acid/ja|アミノ酸]][[Side chain/ja|側鎖]]の[[steric bulk/ja|立体バルク]]を増加させることで安定性が増すことを発見した。さらに安定性を高めるために、''トランス''-[[rotamer/ja|ロータマー]]は[[Intramolecular force/ja|分子内]]で[[pyrrolidine/ja|ピロリジン]]環の''シス''-4,5-メタノ置換で安定化をもたらした。その結果、[[van der Waals force/ja|ファンデルワールス力]]相互作用が生じ、[[Intramolecular reaction/ja|分子内]]環化を防ぐことができる。この安定性の向上により、研究者らは''シス''-4,5-メタノシアノピロリジンの研究を続け、新しい[[adamantyl/ja|アダマンチル]]に行き着いた。この[[Derivative (chemistry)/ja|誘導体]]は、ラット血漿中で驚異的な''生体内''DPP-4阻害作用を示した。また、高い[[microsomal/ja|ミクロソーム]]回転率も注目され、この誘導体が活性[[metabolite/ja|代謝物]]に素早く変換されることを示した。[[adamantyl/ja|アダマンチル]]基の[[hydroxylation/ja|ヒドロキシル化]]後、彼らはより優れた[[microsomal/ja|ミクロソーム]]安定性と改善された化学的安定性を持つ生成物を得た。その製品は[[saxagliptin/ja|サキサグリプチン]](オングリザ)と命名された(''図6'')。2008年6月、[[AstraZeneca]]と[[Bristol-Myers Squibb]]は、オングリザの新薬承認申請を[[:en:United States|米国]]で、販売承認申請を[[:en:Europe|欧州]]で行った。[[:en:United States|米国]]では、2009年7月にFDAからオングリザ5 mgおよびオングリザ2.5 mgの承認を取得した。その後、徐放性[[metformin/ja|メトホルミン]](1日1回服用)と配合され、Kombiglyze XRの商品名で2011年1月にFDAによって承認された。 | ||
=====デナグリプチン===== | |||
===== | |||
デナグリプチン(''図6'')は、P2位に分岐した[[Side chain/ja|側鎖]]を持つ先進的な[[Chemical compound/ja|化合物]]であるが、シアノピロリジン環上に(4''S'')-フルオロ置換を有する。[[GlaxoSmithKline]](GSK)が開発した[[DPP-4 inhibitor/ja|DPP-4阻害薬]]として有名である。生物学的評価により、[[amino acid/ja|アミノ酸]]部分の''S''配座が阻害活性に必須であることが示されている。これらの知見は、今後の[[DPP-4 inhibitor/ja|DPP-4阻害剤]]の設計や合成に役立つであろう。GSKは2008年10月に第III相臨床試験を中断した。 | |||
====アゼチジン系化合物==== | |||
==== | |||
このグループの阻害剤に関する情報はかなり限られている。[[Azetidine/ja|アゼチジン]]ベースの[[DPP-4 inhibitor/ja|DPP-4阻害薬]]は、大まかに3つの主要なサブカテゴリーに分類することができる:2-シアノアゼチジン、3-フルオロアゼチジン、および2-ケトアゼチジンである。最も強力なケトアゼチジンとシアノアゼチジンは大きな[[hydrophobic/ja|疎水性]][[amino acid/ja|アミノ酸]]基が[[azetidine/ja|アゼチジン]][[nitrogen/ja|窒素]]に結合しており、100nM以下で活性を示す。 | |||
===非基質様阻害剤=== | |||
=== | |||
非基質様[[Enzyme inhibitor/ja|阻害剤]]はDPP-4基質のジペプチド性に倣ったものではない。それらは[[Enzyme inhibitor/ja#Reversible inhibitors|非共有結合阻害剤]]であり、通常プロリン模倣体の代わりにS1-ポケットを占める[[aromatic ring/ja|芳香環]]を持っている。 | |||
1999年、[[Merck & Co.|Merck]] はDPP-4阻害薬の[[drug development/ja|薬物開発]]プログラムを開始した。彼らが社内でスクリーニングと[[medicinal chemistry/ja|医薬品化学]]プログラムを開始したとき、すでに2つの[[DPP-4 inhibitor/ja|DPP-4阻害薬]]が[[clinical trials/ja|臨床試験]]に入っていた。イソロイシルチアゾリジド(P32/38)と[[Novartis]]のNVP-DPP728である。L-''threo''-isoleucyl[[thiazolidine/ja|thiazolidide]]とその''allo''[[stereoisomer/ja|立体異性体]]を[[Merck & Co.]]の動物実験において、両[[isomers/ja|異性体]]はDPP-4に対して同様の親和性、同様の''生体内''有効性、同様の[[pharmacokinetic/ja|薬物動態]]および代謝プロファイルを有することが判明した。それにもかかわらず、''allo''異性体は10倍も[[toxic/ja|毒性]]が強かった。研究者らは、この[[toxicity/ja|毒性]]の違いは、''allo''異性体の方が[[DPP8/ja|DPP-8]]と[[DPP9/ja|DPP-9]]をより強く阻害するためであり、DPP-4を選択的に阻害するためではないことを突き止めた。また、DPP-4阻害が免疫機能の低下を引き起こさないことを裏付ける研究も増えている。DPP-8/DPP-9に対する親和性と[[toxicity/ja|毒性]]との間にこの関連性が発見されると、 [[Merck & Co.|Merck]]は、この目的のために、彼らは[[positional scanning libraries/ja|ポジショナル・スキャニング・ライブラリー]]を使用した。これらのライブラリーをスキャンした結果、DPP-4と[[DPP8/ja|DPP-8]]はともにP1位に[[proline/ja|プロリン]]を持つ[[peptide/ja|ペプチド]]を分解することに強い嗜好性を示したが、P2位では大きな違いがあることがわかった。つまり、P2位の酸性官能性が[[DPP8/ja|DPP-8]]よりもDPP-4により大きな親和性を与えることがわかったのである。[[Merck & Co.|Merck]] はさらに研究とスクリーニングを続けた。イソロイシル[[thiazolidine/ja|チアゾリジン]]に関連するα-アミノ酸シリーズの化合物は選択性に欠けるため研究を中止したが、代わりに非常に選択性の高いβ-[[amino acid/ja|アミノ酸]]シリーズを発見した。[[piperazine/ja|ピペラジン]]シリーズを[[structure-activity relationship/ja|SAR]]研究によって発見した。[[piperazine/ja|ピペラジン]][[moiety (chemistry)/ja|部位]]を安定化させようとすると、[[bicyclic/ja|二環式]]誘導体群が作られ、[[potency (pharmacology)/ja|効力]]および選択的なトリアゾロピペラジンシリーズの同定につながった。これらの[[Structural analog/ja|類縁体]]のほとんどは[[preclinical/ja|前臨床]]において優れた[[pharmacokinetic/ja|薬物動態学的]]特性を示した。これらの化合物の最適化が最終的に[[sitagliptin/ja|シタグリプチン]]の発見につながった。 | |||
====シタグリプチン==== | |||
==== | |||
[[File:Sitagliptin.svg|thumb|250px|right|'''図7:'''シタグリプチンの構造]] | |||
[[File:Sitagliptin.svg|thumb|250px|right|''' | [[Sitagliptin/ja|シタグリプチン]](ジャヌビア)は、β-アミノアミド[[Derivative (chemistry)/ja|誘導体]]を付加した新しい構造を持つ(''図7'')。[[Sitagliptin/ja|シタグリプチン]]が優れた選択性と''生体内''での有効性を示したことから、研究者たちはβ-[[amino acid/ja|アミノ酸]]部分を付加した[[DPP-4 inhibitor/ja|DPP-4阻害薬]]の新しい構造の検討を促した。これらの化合物を[[diabetes/ja|糖尿病]]の治療に最適化するために、さらなる研究が進められている。 | ||
[[Sitagliptin]] | 2006年10月、シタグリプチンは[[type 2 diabetes/ja|2型糖尿病]]の治療薬として初めてFDAの承認を得たDPP-4阻害薬となった。[[sitagliptin/ja|シタグリプチン]]の[[Crystallographic/ja|結晶]]構造は、[[molecular modeling/ja|分子モデリング]]とともに、構造的に多様な阻害剤の探索を続けるために使用されている。新しい[[Potency (pharmacology)/ja|効力]]である、DPP-4阻害剤は、[[sitagliptin/ja|シタグリプチン]]の中心[[cyclohexylamine/ja|シクロヘキシルアミン]]を3-アミノピペリジンに置き換えることによって発見された。2-ピリジル置換は、DPP-4に対する効力と選択性に重要な役割を果たすため、最初のSARのブレークスルーとなった。 | ||
[[X-ray/ja|X線]][[crystallography/ja|結晶構造解析]]によって、[[sitagliptin/ja|シタグリプチン]]がどのようにDPP-4複合体に結合するかが示されている: | |||
1. トリフルオロフェニル基はS1-ポケットを占める。 | |||
1. | |||
2. トリフルオロメチル基はArg358残基とSer209残基の側鎖と相互作用する。 | |||
2. | |||
3. [[amino group/ja|アミノ基]]は、Tyr662および2つのグルタミン酸残基Glu205とGlu206のカルボキシル基と[[salt bridge/ja|塩橋]]を形成している。 | |||
3. | |||
4. トリアゾロピペラジン基は残基Phe357の[[phenyl group/ja|フェニル基]]と衝突する。 | |||
4. | |||
[[File:ABT-341.svg|thumb|250px|right|'''図8:'''ABT-341の構造]] | |||
[[File:ABT-341.svg|thumb|250px|right|''' | |||
====拘束型フェニルエチルアミン化合物==== | |||
==== | |||
[[Abbott Laboratories]]の研究者たちは、HTSを用いて3つの新規DPP-4阻害剤シリーズを同定した。さらなる研究と最適化の結果、ABT-341が発見された(''図8'')。ABT-341は強力で選択的なDPP-4阻害剤であり、[[sitagliptin/ja|シタグリプチン]]に非常によく似た2次元構造を持つ。しかし、立体構造はまったく異なっている。ABT-341もまた、S1-ポケットと遊離の[[amino group/ja|アミノ基]]を占めるトリフルオロフェニル基を持つが、2つのカルボニル基は互いに180°離れた方向に配置されている。ABT-341はTyr547とも相互作用すると考えられているが、これはおそらくシクロヘキセニル環と[[tyrosine/ja|チロシン]]側鎖との間の[[steric hindrance/ja|立体障害]]のためであろう。[[Omarigliptin/ja|オマリグリプチン]]はそのような化合物の一つであり、[[Merck & Co]]によってフェーズIIIの開発が進められている。 | |||
====ピロリジン化合物==== | |||
==== | |||
[[pyrrolidine/ja|ピロリジン]]型の[[DPP-4 inhibitor/ja|DPP-4阻害剤]]は、[[High throughput screening/ja|HTS]]の後に初めて発見された。研究により、[[pyrrolidine/ja|ピロリジン]]環が化合物の[[binding site/ja|結合部位]]に適合する部分であることが示された。さらに開発が進められ、優れた活性を示す[[fluoro/ja|フルオロ]]置換ピロリジンや、高い活性を示す縮合シクロプロピル環を持つ[[pyrrolidine/ja|ピロリジン]]が開発された。 | |||
===キサンチン系化合物=== | |||
=== | |||
これは、HTSで同定された別のクラスの阻害剤である。[[Aromatic/ja芳香族]][[heterocyclic/ja|複素環]]ベースの[[DPP-4 inhibitor/ja|DPP-4阻害剤]]が最近注目を集めている。[[DPP-4 inhibitor/ja|DPP-4阻害剤]]として[[xanthine/ja|キサンチン]](''図10'')が最初に特許に記載されたのは[[Boehringer-Ingelheim]](BI)と[[Novo Nordisk]]である。 | |||
[[xanthine/ja|キサンチン]]系DPP-4阻害薬を[[sitagliptin/ja|シタグリプチン]]や[[vildagliptin/ja|ビルダグリプチン]]と比較すると、優れたプロフィールを示している。[[xanthines/ja|キサンチン]]は[[potency (pharmacology)/ja|効力]]が高く、阻害作用がより長く持続し、[[glucose tolerance/ja|耐糖能]]の改善がより長く持続すると考えられている。 | |||
====アログリプチン==== | |||
==== | [[File:Quinazolinone based structure developed to alogliptin.png|thumb|350px|'''図.9:'''開発されたキナゾリノンベースの構造。キナゾリノン構造とアログリプチン]] | ||
[[File:Quinazolinone based structure developed to alogliptin.png|thumb|350px|''' | [[Alogliptin/ja|アログリプチン]](''図9'')は、[[Takeda Pharmaceutical Company|武田薬品工業]]によって開発された新規の[[DPP-4 inhibitor/ja|DPP-4阻害薬]]である。研究者らは、[[quinazolinone/ja|キナゾリノン]]ベースの構造(''図9'')がDPP-4[[Multiprotein complex/ja|複合体]]上の[[active site/ja|活性部位]]と相互作用するのに必要な基を持つだろうという仮説を立てた。[[Quinazolinone/ja|キナゾリノン]]ベースの化合物はDPP-4複合体と効果的に相互作用するが、代謝[[half-life/ja|半減期]]の低さに悩まされていた。そこで、[[quinazolinone/ja|キナゾリノン]]をピリミジンジオンで置き換えると、代謝安定性が向上し、選択的で[[bioavailable/ja|生物学的利用能]]の高い[[DPP-4 inhibitor/ja|DPP-4阻害薬]]が得られることが判明し、[[alogliptin/ja|アログリプチン]]と命名された。このキナゾリン系化合物は、関連[[protease/ja|プロテアーゼ]]である[[DPP8/ja|DPP-8]]に対して強力な阻害作用と優れた選択性を示した。しかし、A環[[phenyl/ja|フェニル]]基の[[oxidation/ja|酸化]]により[[metabolic/ja|代謝]][[half-life/ja|半減期]]が短いという問題があった。研究者たちはまず、[[fluorinated/ja|フッ素化]]誘導体の合成を試みた。この誘導体は代謝安定性が改善され、DPP-4酵素に対する優れた阻害作用を示した。しかし、この誘導体は[[CYP 450/ja|CYP 450]]を阻害することもわかった。3A4を阻害し、[[hERG/ja|hERG]]チャネルをブロックすることがわかった。この問題の解決策として、[[quinazolinone/ja|キナゾリノン]]を他の[[heterocycle/ja|複素環]]に置き換えることが考えられたが、DPP-4阻害作用を失うことなく[[quinazolinone/ja|キナゾリノン]]を置き換えることができた。[[Alogliptin/ja|アログリプチン]]は、キナゾリノンを[[pyrimidinedione/ja|ピリミジンジオン]]に置き換えることで発見された。[[Alogliptin/ja|アログリプチン]]はDPP-4に対して優れた阻害作用を示し、近縁のセリンプロテアーゼ[[DPP8/ja|DPP-8]]や[[DPP9/ja|DPP-9]]に対して10.000倍以上の並外れた選択性を示した。また、[[CYP 450/ja|CYP 450]]酵素を阻害せず、30μMまでの濃度では[[hERG/ja|hERG]]チャネルをブロックしない。このデータに基づいて、[[alogliptin/ja|アログリプチン]]が前臨床評価に選ばれた。2007年1月、[[alogliptin/ja|アログリプチン]]は第III相[[clinical trial/ja|臨床試験]]が進行中であり、2008年10月には[[U.S. Food and Drug Administration/ja|米国食品医薬品局]]の審査を受けていた。 | ||
[[Alogliptin]] | |||
====リナグリプチン==== | |||
= | [[File:Structure of xanthine type DPP-4 inhibitors.svg|thumb|250px|right|'''図10:'''キサンチン型阻害剤'''(上)'''とリナグリプチン'''(下)'''の構造。]] | ||
[[File:Structure of xanthine type DPP-4 inhibitors.svg|thumb|250px|right|''' | |||
BI社の研究者は、ブチ-2-ニル基を使用することで、BI-1356と呼ばれる強力な候補物質が得られることを発見した(''図10'')。2008年、BI-1356は[[Phases of clinical research/ja#Phase III|フェーズIII臨床試験]]が進行中であったが、2011年5月に[[linagliptin/ja|リナグリプチン]]として発売された。[[X-ray crystallography/ja|X線結晶構造解析]]により、[[xanthine/ja|キサンチン]]型は他の[[Enzyme inhibitor/ja|阻害剤]]とは異なる方法でDPP-4複合体と結合することが示されている: | |||
1. アミノ基はGlu205、Glu206、Tyr662とも相互作用する。 | |||
1. | |||
2. ブチル-2-ニル基はS1-ポケットを占める。 | |||
2. | |||
3. ウラシル基はTyr547残基とπスタッキング相互作用を起こす。 | |||
3. | |||
4. キナゾリン基はTrp629残基とπスタッキング相互作用を起こす。 | |||
4. | |||
==薬理学== | ==薬理学== | ||
Latest revision as of 17:16, 12 March 2024
ジペプチジルペプチダーゼ-4阻害薬(DPP-4阻害薬)は、酵素ジペプチジルペプチダーゼ-4 (DPP-4)を阻害する酵素阻害薬である。これらは2型糖尿病の治療に用いられる。DPP-4酵素の阻害は、インスリン分泌と血糖コントロール調節に重要な役割を果たすインクレチンの活性を延長・増強する。 2型糖尿病は、膵臓のβ-cellが身体の必要量を満たすのに十分な量のインスリンを分泌できないことから生じる慢性の代謝性疾患である。インスリン抵抗性および肝グルコース産生の増加もまた、インスリンに対する身体の需要を増加させることによって役割を果たすことがある。インスリン補充以外の現在の治療法は、時にコントロールを達成するのに十分ではなく、体重増加や低血糖などの望ましくない副作用を引き起こすことがある。近年、インスリンの産生機構や体内の糖代謝の調節機構に関する継続的な研究に基づいて、新しい薬物が開発されている。DPP-4という酵素が重要な役割を果たしていることがわかってきた。
歴史
1967年に発見されて以来、セリンプロテアーゼDPP-4は人気のある研究対象であった。DPP-4の阻害剤は、酵素の機能的意義を解明するためのツールとして長い間求められてきた。最初の阻害剤は1980年代後半から1990年代にかけて特徴づけられた。それぞれの阻害剤は、その後の研究のための初期の構造活性相関(SAR)を確立するために重要であった。阻害剤は、DPP-4と共有結合で相互作用するものとそうでないものの2つの主要なクラスに分類される。DPP-4はP1位にプロリンを含む基質と選択的に結合するジペプチダーゼであるため、多くのDPP-4阻害剤はプロリンを模倣した5員複素環を持つ。例えば、ピロリジン、シアノピロリジン、チアゾリジン、シアノチアゾリジンなどである。これらの化合物は一般的に触媒残基Ser630と共有結合を形成する。
1994年、ゼリア新薬の研究者はニトリルを官能基とするシアノピロリジンを発表した。これは触媒であるセリンとイミデートを形成すると想定されていた。同時に、ニトリル基を持たない他のDPP-4阻害剤も発表されたが、それらは他のセリンと相互作用するモチーフ、例えばボロン酸、ホスホン酸またはジアシルヒドロキシルアミンを含んでいた。これらの化合物は、DPP-4とプロリルオリゴペプチダーゼ(PEP)が類似しているために強力ではなく、また化学的不安定性に悩まされていた。フェリング製薬は2つのシアノピロリジンDPP-4阻害剤の特許を申請し、1995年に公開した。これらの化合物は優れた効力を持ち、化学的安定性も改善されていた。
1995年、Novartisのエドウィン・B・ヴィルハウアーは、DPP-4がN-メチルグリシンをN-末端のアミノ酸として同定するという事実に基づいて、N-置換グリシニル-シアノピロリジンの探索を開始した。この新しいシアノピロリジン群は、その後の数年間、非常に人気のある研究分野となった。バソペプチダーゼ阻害はインスリン分泌を刺激することによってDPP-4阻害薬の抗糖尿病効果を増強すると考えられているからである。バソペプチダーゼ阻害モチーフはDPP-4阻害剤とN-置換基でつながっている。
DPP-4のメカニズム
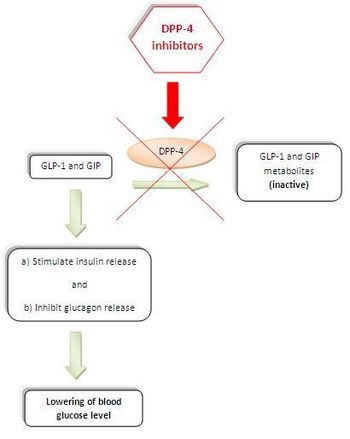
図1:'食事中に、インクレチンであるグルカゴン様ペプチド1(GLP-1)とグルコース依存性胃抑制ポリペプチド(GIP)が小腸から血液中に放出される。これらのホルモンはグルコース依存的にインスリン分泌を調節する。(GLP-1は人体において多くの役割を持っている。インスリンの生合成を刺激し、グルカゴンの分泌を抑制し、胃排出を遅らせ、食欲を減退させ、膵島β-cellの再生を刺激する)
GLP-1とGIPは、酵素DPP-4によって触媒される非常に速い不活性化により、血漿半減期が極めて短い。DPP-4である。DPP-4を阻害すると、これらの不活性化が遅くなり、作用が増強され、血漿中のグルコース濃度が低下するので、2型糖尿病の治療に有用である。(図1)
DPP-4の分布と機能

DPP-4は身体のほとんど全ての臓器の内皮の細胞膜に付着している。DPP-4を強く発現している組織には、外分泌膵臓、汗腺、唾液腺および乳腺、胸腺, リンパ節、胆道、腎臓、肝臓、胎盤、子宮、前立腺、皮膚、腸粘膜の毛細血管床などがある。(ここでほとんどのGLP-1は局所的に不活性化される)。また、血漿や脳脊髄液などの体液にも可溶性で存在する(DPP-4はCD26T細胞を活性化する抗原である)。
DPP-4は、GLP-1やGIPなどのペプチドから、2位にプロリンやアラニンを持つ2つのアミノ酸を選択的に切断する(図2)。DPP-4が効果を発揮する活性部位には、Asp-His-Serの3つのアミノ酸が特徴的に配置されている。 GPL-1やGIPの生物活性にはアラニンとプロリンが重要であるため、これらのアミノ酸を切断することで不活性化される。したがって、インクレチンホルモンの分解を防ぐことができる。分解防止は、2型糖尿病の治療戦略としての可能性を秘めている。
DPP-4の特徴
DPP-4はプロテアーゼであるため、阻害剤がペプチドの性質を持つことは予想外ではなく、このテーマは現代の研究にも受け継がれている。
構造
2003年以降に発表されたDPP-4のX線構造は、結合部位の構造的特徴についてかなり詳細な情報を与えている。多くの構造的に多様なDPP-4阻害剤が発見されており、結合部位の特性を考えればそれほど驚くことではない:
1. 深い親油性ポケットと露出した複数の高親和性低分子結合を達成するための芳香族側鎖が組み合わされている。
2. 阻害剤の物理化学的特性を調整することを可能にする重要な溶媒アクセスは、より良い薬物動態学的挙動につながる。
DPP-4は766アミノ酸からなる膜貫通型糖タンパク質で、プロリルオリゴペプチダーゼファミリーに属する。細胞質尾部、膜貫通領域、細胞外部分の3つの部分からなる。細胞外部分は触媒ドメインと8枚羽根のβ-プロペラドメインに分かれている。後者は阻害剤結合部位に寄与する。触媒ドメインはα/β-ヒドロラーゼのフォールドを示し、Ser630 - Asp708 - His740の触媒トライアドを含む。S1-ポケットは非常に疎水性で、側鎖で構成されている: Tyr631、Val656、Trp662、Tyr666、Val711である。既存のX線構造では、ポケットの大きさや形状に大きな違いはなく、S1-ポケットがプロリン残基に対して高い特異性を持つことを示している。
結合部位

DPP-4阻害剤は通常、活性結合部位の触媒セリンの水酸基と相互作用できる親電子基を持つ(図3)。この基はしばしばニトリル基であるが、ボロン酸やジフェニルホスホネートでもよい。この親電子基はイミデートに結合することができる。複合体と共有結合し、ゆっくりとしたタイトな結合速度で結合できるが、この基はP2-アミノ酸の遊離アミノ基との反応による安定性の問題も引き起こす。そのため、親電子基を持たない阻害剤も開発されているが、これらの分子は他のジペプチジルペプチダーゼ、例えばDPP-2、DPP-8、DPP-9との親和性のために毒性を示す。
DPP-4阻害剤は多様な構造型にまたがっている。2007年には、最も効力のある化合物のうち数種類がプロリン模倣シアノピロリジンP1基を含んでいた。この基は、おそらく活性部位Ser630水酸基によるニトリル基の一時的な共有結合捕捉によるもので、ある種の阻害剤の解離遅延と緩慢な密結合をもたらす。このような効力の増強が達成されたとき、化学的安定性の問題がいくつか指摘され、より高度な分子を作らなければならなくなった。これらの安定性の問題を回避するために、ニトリル基を除外する可能性が検討された。アリールまたは極性側鎖を持つアミノ酸は、ニトリル基を持たない。ニトリル基を持たない化合物はすべて、ニトリル基を持つ化合物に比べて20倍から50倍も効力が低下した。
発見と開発
理想的な治療プロファイルを持つ新規DPP-4阻害剤を発見するためには,迅速かつ正確なシステムを見つけることが重要である。ハイスループットスクリーニング(HTS)では阻害剤を同定するヒット率は通常低いが、バーチャルスクリーニング(VS)では高いヒット率を得ることができる。例えばVSは、DPP-4のS1およびS2部位に配置できるフラグメントを同定するために、小さな一級脂肪族アミンのスクリーニングに使用されている。一方、これらのフラグメントはあまり強力ではなかったため、より優れたフラグメントを設計するための出発点として同定された。 3次元モデルは、新規DPP-4阻害剤の設計に有用なツールを提供することができる。ファーマコフォアモデルは、DPP-4阻害剤活性を有する化合物の主要な化学的特徴に基づいて作成されている。これらのモデルは、阻害活性の原因となる主要な化学的特徴を仮説的に示すことができる。 最初のDPP-4阻害薬は可逆的阻害薬であり、選択性が低いために悪い副作用を伴っていた。研究者たちは、起こりうる副作用を最小限に抑えるためには、半減期の短い阻害薬が好ましいのではないかと考えた。しかし、臨床試験では逆の結果が示されたため、最新のDPP-4阻害薬は効果が長く持続するようになった。最初に報告されたDPP-4阻害薬のひとつがMerckのP32/98である。これはP1-置換体としてチアゾリジドを使用し、動物とヒトの両方で効果を示した最初のDPP-4阻害薬であったが、副作用のために市販薬物には発展しなかった。もう一つの古い阻害剤はNovartisのDPP-728で、P1-置換体として2-シアノピロリジンが使われている。シアノ基の付加は一般に効力を増大させる。そのため、研究者の関心はこれらの化合物に向けられた。通常、DPP-4阻害剤は基質様か非基質様のどちらかである。

基質様阻害剤
基質様阻害剤(図4)は非基質様阻害剤よりも一般的である。これらは共有結合または非共有結合で結合し、P1-置換基がS1-ポケットを、P2-置換基がS2-ポケットを占める基本構造を持っている。通常はプロリン模倣体がS1-ポケットを占める。2-シアノピロリジン環上の大きな置換基は、S1-ポケットが非常に小さいため、通常は許容されない。 DPP-4はT細胞の活性化マーカーCD26と同一であり、DPP-4阻害剤はT細胞の増殖を阻害することが知られているため、これらの化合物は当初、潜在的な免疫調節剤であると考えられていた。2型糖尿病に対する機能が発見されると、シアノピロリジンは非常に人気のある研究材料となった。その後、現在までに最も開発されたシアノピロリジン系DPP-4阻害薬であるビルダグリプチンとサキサグリプチンが発見された。
シアノピロリジン
シアノピロリジンにはDPP-4複合体に対して2つの重要な相互作用がある:
1. ニトリルはペプチド性基質のシシル結合の位置にあり、高活性に重要である。ニトリル基は触媒活性を持つセリンヒドロキシル(Ser630)と可逆的な共有結合を形成する、すなわちシアノピロリジンは解離速度が遅い競合的阻害剤である。
2. プロトン化されたアミノ基とタンパク質表面の負荷電領域であるGlu205、Glu206、Tyr662との間の水素結合ネットワーク。すべてのシアノピロリジンは塩基性、第一級または第二級アミンを持っており、それがこのネットワークを可能にしているが、これらの化合物は通常、これらのアミンを変えると効力が低下する。それにもかかわらず、2つの特許出願は、アミノ基を変える、すなわちヒドラジンで置換することができることを明らかにしているが、これらの化合物はDPP-4阻害を通じて作用するだけでなく、ラジカル(化学)|ラジカルスカベンジャーとして作用することによって糖尿病性血管合併症を予防するとも主張している。
構造活性相関(SAR)
重要な構造活性相関:
1. シアノピロリジン系阻害剤のピロリジン環の周囲には厳しい立体的制約が存在し、水素、フッ素、アセチレン、ニトリル、またはメタノ置換のみが許される。
2. ピロリジン環上にニトリル部位が存在することは、強力な活性を得るために重要である
また、系統的なSAR調査により、P2位の環のサイズと立体化学がかなり条件的であることが示された。5員環でL配位は、4員環や6員環でD配位よりも良い結果を示している。ピロリジン環は、疎水性S1ポケットとの適合性が非常に重要であるため、ピロリジン環のわずかな変化しか許容できない。S1ポケットは高い親和性を得るために非常に重要である。例えば、ピロリジンをチアゾリンで置き換えるなどの試みがなされている。その結果、効力は改善されたが、化学的安定性は失われた。化学的安定性を改善する努力は、しばしばDPP-8やDPP-9との相互作用のために特異性を失うことにつながった。これらの相互作用は、動物における毒性や死亡率の増加に関係している。P1ポジションには厳しい制限があり、ほとんど変更は許されない。一方、P2位ではさまざまな変更が可能である。実際、置換でかなり大きな分岐側鎖、例えばtert-ブチルグリシンを用いると、通常は活性と化学的安定性が向上し、DPP-4酵素の阻害がより長く続く可能性がある。また、ビアリールベースの側鎖も高活性の阻害剤を与えることができることが指摘されている。当初は親油性置換のみが許容されると考えられていた。現在では、親水性置換だけでなく、極性負電荷を帯びた側鎖の置換も優れた阻害活性につながると述べられている。
化学的安定性

一般的に、DPP-4阻害剤はあまり安定な化合物ではない。そのため、多くの研究者がシアノピロリジンの安定性を高めることに注力している。化学的安定性を向上させる最も広範な技術は、立体バルクを組み込むことである。最も顕著な2つのシアノピロリジン、ビルダグリプチンとサキサグリプチンはこの方法で作られた。K579は協和発酵キョーゴーの研究者によって発見されたDPP-4阻害薬である。K579は化学的安定性だけでなく、作用の持続性も改善されていた。この長時間作用は、酵素-阻害剤複合体と活性のある腸肝循環を受ける酸化代謝物の解離が遅いためと考えられる。活性酸化物の発見は、ビルダグリプチンとサキサグリプチンの開発につながったので、事実大きなブレークスルーであった。DPP-4阻害薬の安定性における大きな問題の一つは分子内環化である。分子内環化の前提条件は、DPP-4結合ロータマーであるtrans-ロータマーの変換である(図5)。従って、この変換を防げば安定性が増す。アミド基を環に組み込むと、DPP-4阻害活性を維持し、分子内環化を起こさず、異なるDPP酵素に対してさらに選択的な化合物を作り出すことができた。また、P1位にシアノアゼチジンを、P2位にβ-アミノ酸を導入すると安定性が増すことも報告されている。
ビルダグリプチン
ビルダグリプチン(ガルバス)(図6)は1998年5月に初めて合成され、Edwin B. Villhauerにちなんで命名された。Novartis/jaの研究者が、非常に効能が高いことが証明されていたアダマンチル誘導体を調べたときに発見された。アダマンチル基は立体バルクとして働き、化学的安定性を高めながら分子内環化を遅らせた。さらに、一次代謝物は高活性であった。さらなるキラル中心を避けるために、アダマンチル環でのヒドロキシル化が行われた(図6)。生成物であるビルダグリプチンはさらに安定であり、分子内環化反応は30倍遅く、高いDPP-4阻害剤活性と薬力学的効果がより長く持続した。
サキサグリプチン

Bristol-Myers Squibbの研究者たちは、N末端のアミノ酸側鎖の立体バルクを増加させることで安定性が増すことを発見した。さらに安定性を高めるために、トランス-ロータマーは分子内でピロリジン環のシス-4,5-メタノ置換で安定化をもたらした。その結果、ファンデルワールス力相互作用が生じ、分子内環化を防ぐことができる。この安定性の向上により、研究者らはシス-4,5-メタノシアノピロリジンの研究を続け、新しいアダマンチルに行き着いた。この誘導体は、ラット血漿中で驚異的な生体内DPP-4阻害作用を示した。また、高いミクロソーム回転率も注目され、この誘導体が活性代謝物に素早く変換されることを示した。アダマンチル基のヒドロキシル化後、彼らはより優れたミクロソーム安定性と改善された化学的安定性を持つ生成物を得た。その製品はサキサグリプチン(オングリザ)と命名された(図6)。2008年6月、AstraZenecaとBristol-Myers Squibbは、オングリザの新薬承認申請を米国で、販売承認申請を欧州で行った。米国では、2009年7月にFDAからオングリザ5 mgおよびオングリザ2.5 mgの承認を取得した。その後、徐放性メトホルミン(1日1回服用)と配合され、Kombiglyze XRの商品名で2011年1月にFDAによって承認された。
デナグリプチン
デナグリプチン(図6)は、P2位に分岐した側鎖を持つ先進的な化合物であるが、シアノピロリジン環上に(4S)-フルオロ置換を有する。GlaxoSmithKline(GSK)が開発したDPP-4阻害薬として有名である。生物学的評価により、アミノ酸部分のS配座が阻害活性に必須であることが示されている。これらの知見は、今後のDPP-4阻害剤の設計や合成に役立つであろう。GSKは2008年10月に第III相臨床試験を中断した。
アゼチジン系化合物
このグループの阻害剤に関する情報はかなり限られている。アゼチジンベースのDPP-4阻害薬は、大まかに3つの主要なサブカテゴリーに分類することができる:2-シアノアゼチジン、3-フルオロアゼチジン、および2-ケトアゼチジンである。最も強力なケトアゼチジンとシアノアゼチジンは大きな疎水性アミノ酸基がアゼチジン窒素に結合しており、100nM以下で活性を示す。
非基質様阻害剤
非基質様阻害剤はDPP-4基質のジペプチド性に倣ったものではない。それらは非共有結合阻害剤であり、通常プロリン模倣体の代わりにS1-ポケットを占める芳香環を持っている。
1999年、Merck はDPP-4阻害薬の薬物開発プログラムを開始した。彼らが社内でスクリーニングと医薬品化学プログラムを開始したとき、すでに2つのDPP-4阻害薬が臨床試験に入っていた。イソロイシルチアゾリジド(P32/38)とNovartisのNVP-DPP728である。L-threo-isoleucylthiazolidideとそのallo立体異性体をMerck & Co.の動物実験において、両異性体はDPP-4に対して同様の親和性、同様の生体内有効性、同様の薬物動態および代謝プロファイルを有することが判明した。それにもかかわらず、allo異性体は10倍も毒性が強かった。研究者らは、この毒性の違いは、allo異性体の方がDPP-8とDPP-9をより強く阻害するためであり、DPP-4を選択的に阻害するためではないことを突き止めた。また、DPP-4阻害が免疫機能の低下を引き起こさないことを裏付ける研究も増えている。DPP-8/DPP-9に対する親和性と毒性との間にこの関連性が発見されると、 Merckは、この目的のために、彼らはポジショナル・スキャニング・ライブラリーを使用した。これらのライブラリーをスキャンした結果、DPP-4とDPP-8はともにP1位にプロリンを持つペプチドを分解することに強い嗜好性を示したが、P2位では大きな違いがあることがわかった。つまり、P2位の酸性官能性がDPP-8よりもDPP-4により大きな親和性を与えることがわかったのである。Merck はさらに研究とスクリーニングを続けた。イソロイシルチアゾリジンに関連するα-アミノ酸シリーズの化合物は選択性に欠けるため研究を中止したが、代わりに非常に選択性の高いβ-アミノ酸シリーズを発見した。ピペラジンシリーズをSAR研究によって発見した。ピペラジン部位を安定化させようとすると、二環式誘導体群が作られ、効力および選択的なトリアゾロピペラジンシリーズの同定につながった。これらの類縁体のほとんどは前臨床において優れた薬物動態学的特性を示した。これらの化合物の最適化が最終的にシタグリプチンの発見につながった。
シタグリプチン
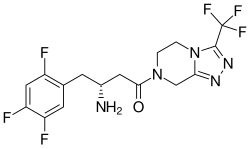
シタグリプチン(ジャヌビア)は、β-アミノアミド誘導体を付加した新しい構造を持つ(図7)。シタグリプチンが優れた選択性と生体内での有効性を示したことから、研究者たちはβ-アミノ酸部分を付加したDPP-4阻害薬の新しい構造の検討を促した。これらの化合物を糖尿病の治療に最適化するために、さらなる研究が進められている。 2006年10月、シタグリプチンは2型糖尿病の治療薬として初めてFDAの承認を得たDPP-4阻害薬となった。シタグリプチンの結晶構造は、分子モデリングとともに、構造的に多様な阻害剤の探索を続けるために使用されている。新しい効力である、DPP-4阻害剤は、シタグリプチンの中心シクロヘキシルアミンを3-アミノピペリジンに置き換えることによって発見された。2-ピリジル置換は、DPP-4に対する効力と選択性に重要な役割を果たすため、最初のSARのブレークスルーとなった。
X線結晶構造解析によって、シタグリプチンがどのようにDPP-4複合体に結合するかが示されている:
1. トリフルオロフェニル基はS1-ポケットを占める。
2. トリフルオロメチル基はArg358残基とSer209残基の側鎖と相互作用する。
3. アミノ基は、Tyr662および2つのグルタミン酸残基Glu205とGlu206のカルボキシル基と塩橋を形成している。
4. トリアゾロピペラジン基は残基Phe357のフェニル基と衝突する。

拘束型フェニルエチルアミン化合物
Abbott Laboratoriesの研究者たちは、HTSを用いて3つの新規DPP-4阻害剤シリーズを同定した。さらなる研究と最適化の結果、ABT-341が発見された(図8)。ABT-341は強力で選択的なDPP-4阻害剤であり、シタグリプチンに非常によく似た2次元構造を持つ。しかし、立体構造はまったく異なっている。ABT-341もまた、S1-ポケットと遊離のアミノ基を占めるトリフルオロフェニル基を持つが、2つのカルボニル基は互いに180°離れた方向に配置されている。ABT-341はTyr547とも相互作用すると考えられているが、これはおそらくシクロヘキセニル環とチロシン側鎖との間の立体障害のためであろう。オマリグリプチンはそのような化合物の一つであり、Merck & CoによってフェーズIIIの開発が進められている。
ピロリジン化合物
ピロリジン型のDPP-4阻害剤は、HTSの後に初めて発見された。研究により、ピロリジン環が化合物の結合部位に適合する部分であることが示された。さらに開発が進められ、優れた活性を示すフルオロ置換ピロリジンや、高い活性を示す縮合シクロプロピル環を持つピロリジンが開発された。
キサンチン系化合物
これは、HTSで同定された別のクラスの阻害剤である。Aromatic/ja芳香族複素環ベースのDPP-4阻害剤が最近注目を集めている。DPP-4阻害剤としてキサンチン(図10)が最初に特許に記載されたのはBoehringer-Ingelheim(BI)とNovo Nordiskである。 キサンチン系DPP-4阻害薬をシタグリプチンやビルダグリプチンと比較すると、優れたプロフィールを示している。キサンチンは効力が高く、阻害作用がより長く持続し、耐糖能の改善がより長く持続すると考えられている。
アログリプチン

アログリプチン(図9)は、武田薬品工業によって開発された新規のDPP-4阻害薬である。研究者らは、キナゾリノンベースの構造(図9)がDPP-4複合体上の活性部位と相互作用するのに必要な基を持つだろうという仮説を立てた。キナゾリノンベースの化合物はDPP-4複合体と効果的に相互作用するが、代謝半減期の低さに悩まされていた。そこで、キナゾリノンをピリミジンジオンで置き換えると、代謝安定性が向上し、選択的で生物学的利用能の高いDPP-4阻害薬が得られることが判明し、アログリプチンと命名された。このキナゾリン系化合物は、関連プロテアーゼであるDPP-8に対して強力な阻害作用と優れた選択性を示した。しかし、A環フェニル基の酸化により代謝半減期が短いという問題があった。研究者たちはまず、フッ素化誘導体の合成を試みた。この誘導体は代謝安定性が改善され、DPP-4酵素に対する優れた阻害作用を示した。しかし、この誘導体はCYP 450を阻害することもわかった。3A4を阻害し、hERGチャネルをブロックすることがわかった。この問題の解決策として、キナゾリノンを他の複素環に置き換えることが考えられたが、DPP-4阻害作用を失うことなくキナゾリノンを置き換えることができた。アログリプチンは、キナゾリノンをピリミジンジオンに置き換えることで発見された。アログリプチンはDPP-4に対して優れた阻害作用を示し、近縁のセリンプロテアーゼDPP-8やDPP-9に対して10.000倍以上の並外れた選択性を示した。また、CYP 450酵素を阻害せず、30μMまでの濃度ではhERGチャネルをブロックしない。このデータに基づいて、アログリプチンが前臨床評価に選ばれた。2007年1月、アログリプチンは第III相臨床試験が進行中であり、2008年10月には米国食品医薬品局の審査を受けていた。
リナグリプチン

BI社の研究者は、ブチ-2-ニル基を使用することで、BI-1356と呼ばれる強力な候補物質が得られることを発見した(図10)。2008年、BI-1356はフェーズIII臨床試験が進行中であったが、2011年5月にリナグリプチンとして発売された。X線結晶構造解析により、キサンチン型は他の阻害剤とは異なる方法でDPP-4複合体と結合することが示されている:
1. アミノ基はGlu205、Glu206、Tyr662とも相互作用する。
2. ブチル-2-ニル基はS1-ポケットを占める。
3. ウラシル基はTyr547残基とπスタッキング相互作用を起こす。
4. キナゾリン基はTrp629残基とπスタッキング相互作用を起こす。
薬理学
| 薬剤 | 吸収 | 生物学的利用能 (%) | IC50 (nM) | 平均分布容積 (L) | タンパク質結合 (%) | 半減期 (時間,100 mg ドーズ) | 代謝 | 排泄 |
|---|---|---|---|---|---|---|---|---|
| シタグリプチン | 急速に吸収され、1~4時間で濃度がピークに達する | 87 | 18 | 198 | 38 | 12.4 | ごく一部はCYP 450 3A4および2C8を経由して肝代謝を受ける | 未変化体のまま尿中に排出される (79%) |
| ビルダグリプチン | 急速に吸収され、1~2時間で濃度がピークに達する | 85 | 3 | 70.5 | 9.3 | 1.68(1日1回)、2.54(1日2回) | 加水分解により薬理学的に不活性な代謝物が生じる。一部(22%)は腎臓から未変化体として排泄される。 | 代謝物の排泄は尿(85%)と糞便(15%)を通じて行われる。 |
シタグリプチンおよびビルダグリプチンの薬物動態学的特性は、年齢、性別、またはBMIの影響を受けないようである。臨床研究では、シタグリプチンおよびビルダグリプチンには、2型糖尿病の治療後に起こりがちな副作用、例えば体重増加や高血糖がないことが示されている。感染症、咽頭痛、下痢などの副作用も認められている。