Ethyl eicosapentaenoic acid/ja: Difference between revisions
Created page with "イコサペントエチルの有効性と安全性は、冠動脈、脳血管、頸動脈、末梢動脈疾患の既往歴が記録されている45歳以上、または糖尿病と心血管疾患の追加危険因子を有する50歳以上の参加者8,179人を対象とした試験で確立された。イコサペントエチルを投与された参加者は、脳卒中や心臓発作などの心血管イベントを経験する可能性が有意に低かった。" Tags: Mobile edit Mobile web edit |
No edit summary |
||
| (3 intermediate revisions by the same user not shown) | |||
| Line 1: | Line 1: | ||
<languages /> | <languages /> | ||
{{PathNav|Medication/ja|Lipid-lowering agent/ja|frame=1}} | |||
{{Infobox drug | {{Infobox drug | ||
| Verifiedfields = changed | | Verifiedfields = changed | ||
| Line 118: | Line 119: | ||
米国では、イコサペントエチルは、トリグリセリド値が高く(150 mg/dL以上)、心血管疾患または糖尿病が確立しており、さらに2つ以上の心血管疾患の危険因子を有する成人において、心筋梗塞、脳卒中、冠動脈血行再建術、入院を要する不安定狭心症のリスクを軽減するために、最大限の忍容性を有するスタチン療法の補助薬として適応されている。また、重度(500 mg/dL以上)の高トリグリセリド血症の成人において、トリグリセリド値を低下させるための食事療法の補助としても適応がある。 | 米国では、イコサペントエチルは、トリグリセリド値が高く(150 mg/dL以上)、心血管疾患または糖尿病が確立しており、さらに2つ以上の心血管疾患の危険因子を有する成人において、心筋梗塞、脳卒中、冠動脈血行再建術、入院を要する不安定狭心症のリスクを軽減するために、最大限の忍容性を有するスタチン療法の補助薬として適応されている。また、重度(500 mg/dL以上)の高トリグリセリド血症の成人において、トリグリセリド値を低下させるための食事療法の補助としても適応がある。 | ||
一般に、トリグリセリドを有意に(15%以上)低下させるためには、処方薬物または栄養補助食品として長鎖オメガ-3脂肪酸を大量(2.0~4.0g/日)摂取する必要があり、その摂取量では、その効果は有意(20%~35%、500 mg/dLを超える人では最大45%)になる可能性がある。エイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)の両方がトリグリセリドを低下させるようであるが、DHA単独では[[low-density lipoprotein/ja|低比重リポタンパク質]](アテローム性動脈硬化を促進する変異体; "悪玉コレステロール"と呼ばれることもある)と[[LDL-C/ja|LDL-C]] | 一般に、トリグリセリドを有意に(15%以上)低下させるためには、処方薬物または栄養補助食品として長鎖オメガ-3脂肪酸を大量(2.0~4.0g/日)摂取する必要があり、その摂取量では、その効果は有意(20%~35%、500 mg/dLを超える人では最大45%)になる可能性がある。エイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)の両方がトリグリセリドを低下させるようであるが、DHA単独では[[low-density lipoprotein/ja|低比重リポタンパク質]](アテローム性動脈硬化を促進する変異体; "悪玉コレステロール"と呼ばれることもある)と[[LDL-C/ja|LDL-C]]値(最も一般的なのは計算上の推定値であり、技術的およびコスト的な理由から、研究室が個人の血液サンプルから測定することはない;しかし、これはあまり一般的でないNMR脂質パネル研究室では正確に計算される)を上昇させるが、イコサペンタエン酸(EPA)単独では上昇せず、代わりに前述のパラメーターを低下させる。 | ||
<span id="Other_fish-oil_based_drugs"></span> | <span id="Other_fish-oil_based_drugs"></span> | ||
| Line 139: | Line 140: | ||
==薬理学{{Anchor|Pharmacology}}== | ==薬理学{{Anchor|Pharmacology}}== | ||
摂取後、イコサペンタエン酸エチル(E-EPA)はイコサペンタエン酸(EPA)に代謝される。EPAは小腸で吸収され、循環に入る。血漿中濃度のピークは摂取後約5時間で、半減期は約89時間である。EPAは主に肝臓で脂肪分解される。 | |||
==作用機序{{Anchor|Mechanism of action}}== | ==作用機序{{Anchor|Mechanism of action}}== | ||
イコサペンタエン酸エチル(E-EPA)の活性代謝物であるイコサペンタエン酸(EPA)は、他のオメガ-3脂肪酸ベースの薬物と同様に、肝臓でのトリグリセリドの産生を減少させ、循環[[very low-density lipoprotein/ja|超低比重リポタンパク質]](VLDL)粒子からのトリグリセリドのクリアランスを促進するようである。その作用機序は明らかではないが、[[beta oxidation/ja|脂肪酸の分解]]の亢進、肝臓でのトリグリセリドの生合成に関与する[[diglyceride acyltransferase/ja|ジグリセリドアシルトランスフェラーゼ]]の阻害、血中の[[lipoprotein lipase/ja|リポ蛋白リパーゼ]]活性の亢進などが考えられる。 | |||
==化学{{Anchor|Chemistry}}== | ==化学{{Anchor|Chemistry}}== | ||
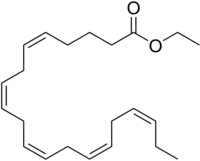
イコサペンタエン酸エチル(E-EPA)は、[[omega-3 fatty acid/ja|オメガ3脂肪酸]]である[[eicosapentaenoic acid/ja|イコサペンタエン酸]]のエチル[[ester/ja|エステル]]である。 | |||
==歴史{{Anchor|History}}== | ==歴史{{Anchor|History}}== | ||
2012年7月、米国[[Food and Drug Administration/ja|食品医薬品局]](FDA)は、食事療法の補助として重度の[[hypertriglyceridemia/ja|高トリグリセリド血症]] | 2012年7月、米国[[Food and Drug Administration/ja|食品医薬品局]](FDA)は、食事療法の補助として重度の[[hypertriglyceridemia/ja|高トリグリセリド血症]]にイコサペンタエン酸エチル(E-EPA)を承認した。アマリン社は、[[off-label use/ja|適応外使用]]のために薬物を販売する能力を制限するFDAの権限に異議を唱え、2012年に控訴審で勝訴し、FDAが医薬品の販売を規制する方法を変えた。 | ||
エイコサペンタエン酸エチル(E-EPA)は、[[omega-3-acid ethyl esters/ja|オメガ-3-酸エチルエステル]]([[GlaxoSmithKline]]のLovaza、2004年に承認)に次いで承認された2番目の魚油薬物であった。2つの薬物のラベルは似ていたが、医師はいくつかの臨床的根拠に基づいて、トリグリセリドが500 mg/dLより低い人にロバザを処方した。アマリンはE-EPAをそのような人々にも積極的に販売し、収益を大幅に拡大したいと考えており、2013年にFDAにその許可を申請したが、FDAは拒否した。これに対してアマリンは2015年5月、[[:en:First Amendment|憲法修正第1条]]の権利を侵害しているとしてFDAを提訴し、2015年8月、判事はFDAは "未承認用途の薬物の真実のプロモーションを禁止することは言論の自由の保護に反するので禁止できない"という判決を下した。この判決は、アマリンがE-EPAについて何を言うことをFDAが許可するかという問題を残したままであり、2016年3月、FDAとアマリンは、アマリンが具体的な販売資料をFDAに提出し、FDAの審査を受けることで合意した(処方医薬品の場合は通常通り)。もしその資料が真実かどうかで意見が対立した場合、両当事者は裁判官に調停を求めることになる。 | エイコサペンタエン酸エチル(E-EPA)は、[[omega-3-acid ethyl esters/ja|オメガ-3-酸エチルエステル]]([[GlaxoSmithKline]]のLovaza、2004年に承認)に次いで承認された2番目の魚油薬物であった。2つの薬物のラベルは似ていたが、医師はいくつかの臨床的根拠に基づいて、トリグリセリドが500 mg/dLより低い人にロバザを処方した。アマリンはE-EPAをそのような人々にも積極的に販売し、収益を大幅に拡大したいと考えており、2013年にFDAにその許可を申請したが、FDAは拒否した。これに対してアマリンは2015年5月、[[:en:First Amendment|憲法修正第1条]]の権利を侵害しているとしてFDAを提訴し、2015年8月、判事はFDAは "未承認用途の薬物の真実のプロモーションを禁止することは言論の自由の保護に反するので禁止できない"という判決を下した。この判決は、アマリンがE-EPAについて何を言うことをFDAが許可するかという問題を残したままであり、2016年3月、FDAとアマリンは、アマリンが具体的な販売資料をFDAに提出し、FDAの審査を受けることで合意した(処方医薬品の場合は通常通り)。もしその資料が真実かどうかで意見が対立した場合、両当事者は裁判官に調停を求めることになる。 | ||
Latest revision as of 22:16, 15 April 2024
 | |
| Clinical data | |
|---|---|
| Trade names | Vascepa, Vazkepa |
| Other names | Eicosapentaenoic acid ethyl ester; Ethyl eicosapentaenoate; Eicosapent; EPA ethyl ester; E-EPA, Icosapent ethyl (USAN US) |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a613024 |
| License data | |
| Pregnancy category |
|
| Routes of administration | 経口 |
| Drug class | Antilipemic Agents |
| ATC code |
|
| Legal status | |
| Legal status | |
| Identifiers | |
| |
| CAS Number | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Chemical and physical data | |
| Formula | C22H34O2 |
| Molar mass | 330.512 g·mol−1 |
| 3D model (JSmol) | |
| |
| |
| | |
イコサペンタエン酸エチル(E-EPA、icosapent ethyl)は、脂質異常症および高トリグリセリド血症の治療に用いられる医薬品である。150 mg/dL以上の高トリグリセリド血症の成人には、食事の変更と併用して使用される。さらに、スタチン(最大耐用量)との併用が求められることが多い。
最も一般的な副作用は、筋骨格痛、末梢性浮腫(脚や手のむくみ)、心房細動、関節痛(関節の痛み)である。その他の一般的な副作用としては、出血、便秘、痛風、発疹などがある。
オメガ3脂肪酸から作られる。イコサペンタエン酸(EPA)を原料としている。米国食品医薬品局(FDA)は2012年、アマリン社にイコサペントエチルの承認を与え、オメガ3酸エチルエステル(商品名Lovaza、それ自体は2004年に承認)に次ぐ2番目の魚油ベースの医薬品となった。2019年12月13日、FDAはVascepaを「トリグリセリド値が上昇した人々の心血管リスクを低減する」ことに特化した初めての薬物としても承認した。これはジェネリック医薬品として販売されている。2020年には、1 万件以上の処方で、米国で最も処方されている医薬品285位であった。
医療用途
欧州連合(EU)では、イコサペントエチルはスタチン療法の補助として心血管リスクを軽減する効能である。
米国では、イコサペントエチルは、トリグリセリド値が高く(150 mg/dL以上)、心血管疾患または糖尿病が確立しており、さらに2つ以上の心血管疾患の危険因子を有する成人において、心筋梗塞、脳卒中、冠動脈血行再建術、入院を要する不安定狭心症のリスクを軽減するために、最大限の忍容性を有するスタチン療法の補助薬として適応されている。また、重度(500 mg/dL以上)の高トリグリセリド血症の成人において、トリグリセリド値を低下させるための食事療法の補助としても適応がある。
一般に、トリグリセリドを有意に(15%以上)低下させるためには、処方薬物または栄養補助食品として長鎖オメガ-3脂肪酸を大量(2.0~4.0g/日)摂取する必要があり、その摂取量では、その効果は有意(20%~35%、500 mg/dLを超える人では最大45%)になる可能性がある。エイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)の両方がトリグリセリドを低下させるようであるが、DHA単独では低比重リポタンパク質(アテローム性動脈硬化を促進する変異体; "悪玉コレステロール"と呼ばれることもある)とLDL-C値(最も一般的なのは計算上の推定値であり、技術的およびコスト的な理由から、研究室が個人の血液サンプルから測定することはない;しかし、これはあまり一般的でないNMR脂質パネル研究室では正確に計算される)を上昇させるが、イコサペンタエン酸(EPA)単独では上昇せず、代わりに前述のパラメーターを低下させる。
その他の魚油ベースの薬物
オメガ3系魚油をベースにした薬物は他にもあり、用途や作用機序が似ている:
- オメガ-3-酸エチルエステル(商品名オマコール[米国ではアミカーやオムトリグとの混同を避けるためロバザに改称])、2016年3月現在、4種類のジェネリック医薬品がある。
- オメガ-3カルボン酸(Epanova);Epanovaの商品名は米国で販売中止となった。
栄養補助食品
海産物をベースとしたオメガ3系サプリメントには、心血管疾患や早死を抑制する効果があることが示唆されている。 これらの効果は、糖尿病患者のような他の集団では発揮されないかもしれない。 栄養補助食品の成分は、処方薬ほど注意深く管理されておらず、処方薬のように臨床試験で固定されテストされていない、 また、処方箋の形態はより濃縮されているため、服用するカプセルの数が少なくて済み、コンプライアンスが向上する可能性が高い。
副作用
魚介類アレルギーのある人は特に注意が必要である。また、他のオメガ3脂肪酸と同様に、エイコサペンタエン酸エチル(E-EPA)を摂取すると、抗凝固薬を服用している人は出血時間が延長するリスクがある。 臨床試験で最も多く報告された副作用は関節痛であり、口や喉の痛みを報告した人もいる。E-EPAは妊娠中の女性ではテストされていない;母乳中に排泄され、乳児への影響はわかっていない。
薬理学
摂取後、イコサペンタエン酸エチル(E-EPA)はイコサペンタエン酸(EPA)に代謝される。EPAは小腸で吸収され、循環に入る。血漿中濃度のピークは摂取後約5時間で、半減期は約89時間である。EPAは主に肝臓で脂肪分解される。
作用機序
イコサペンタエン酸エチル(E-EPA)の活性代謝物であるイコサペンタエン酸(EPA)は、他のオメガ-3脂肪酸ベースの薬物と同様に、肝臓でのトリグリセリドの産生を減少させ、循環超低比重リポタンパク質(VLDL)粒子からのトリグリセリドのクリアランスを促進するようである。その作用機序は明らかではないが、脂肪酸の分解の亢進、肝臓でのトリグリセリドの生合成に関与するジグリセリドアシルトランスフェラーゼの阻害、血中のリポ蛋白リパーゼ活性の亢進などが考えられる。
化学
イコサペンタエン酸エチル(E-EPA)は、オメガ3脂肪酸であるイコサペンタエン酸のエチルエステルである。
歴史
2012年7月、米国食品医薬品局(FDA)は、食事療法の補助として重度の高トリグリセリド血症にイコサペンタエン酸エチル(E-EPA)を承認した。アマリン社は、適応外使用のために薬物を販売する能力を制限するFDAの権限に異議を唱え、2012年に控訴審で勝訴し、FDAが医薬品の販売を規制する方法を変えた。
エイコサペンタエン酸エチル(E-EPA)は、オメガ-3-酸エチルエステル(GlaxoSmithKlineのLovaza、2004年に承認)に次いで承認された2番目の魚油薬物であった。2つの薬物のラベルは似ていたが、医師はいくつかの臨床的根拠に基づいて、トリグリセリドが500 mg/dLより低い人にロバザを処方した。アマリンはE-EPAをそのような人々にも積極的に販売し、収益を大幅に拡大したいと考えており、2013年にFDAにその許可を申請したが、FDAは拒否した。これに対してアマリンは2015年5月、憲法修正第1条の権利を侵害しているとしてFDAを提訴し、2015年8月、判事はFDAは "未承認用途の薬物の真実のプロモーションを禁止することは言論の自由の保護に反するので禁止できない"という判決を下した。この判決は、アマリンがE-EPAについて何を言うことをFDAが許可するかという問題を残したままであり、2016年3月、FDAとアマリンは、アマリンが具体的な販売資料をFDAに提出し、FDAの審査を受けることで合意した(処方医薬品の場合は通常通り)。もしその資料が真実かどうかで意見が対立した場合、両当事者は裁判官に調停を求めることになる。
2019年12月、FDAは、トリグリセリド値(血液中の脂肪の一種)が1デシリットル当たり150ミリグラム以上上昇した成人において、心血管イベントのリスクを低減するための補助(二次)療法としてイコサペントエチルの使用を承認した。また、心血管疾患が単独で確立しているか、糖尿病に加えて心血管疾患の危険因子が2つ以上あることが条件となる。
イコサペントエチルは、最大耐容量のスタチン療法に追加することで、トリグリセリド値が高い人の心血管リスクを低減する薬物として初めてFDAに承認された。
イコサペントエチルの有効性と安全性は、冠動脈、脳血管、頸動脈、末梢動脈疾患の既往歴が記録されている45歳以上、または糖尿病と心血管疾患の追加危険因子を有する50歳以上の参加者8,179人を対象とした試験で確立された。イコサペントエチルを投与された参加者は、脳卒中や心臓発作などの心血管イベントを経験する可能性が有意に低かった。
臨床試験において、イコサペントエチルは入院を必要とする心房細動または心房粗動(不整脈)のリスク増加と関連していた。心房細動の発生率は心房細動または心房粗動の既往のある患者でより高かった。イコサペントエチルは出血イベントのリスク増加とも関連していた。出血の発生率は、アスピリン、クロピドグレル、ワルファリンのような出血のリスクを高める他の医薬品を同時に服用している患者で高かった。
社会と文化
法的地位
2021年1月28日、欧州医薬品庁(EMA)のヒト用医薬品委員会(CHMP)は、心血管リスクが高い人の心血管イベントリスク軽減を目的とした医薬品バズケパの販売承認を推奨する肯定的意見を採択した。この医薬品の申請者はAmarin Pharmaceuticals社である。アイルランド・リミテッドである。2021年3月に欧州連合(EU)で医薬品として承認されている。