Omega-3 acid ethyl esters/ja: Difference between revisions
Created page with "==副作用{{Anchor|Side effects}}== 魚介類アレルギーのある人は特に注意が必要である。また、他のオメガ3脂肪酸と同様に、オメガ3酸エチルエステルを摂取すると、抗凝固薬を服用している人は出血時間が延長するリスクがある。" Tags: Mobile edit Mobile web edit |
No edit summary |
||
| (10 intermediate revisions by 2 users not shown) | |||
| Line 1: | Line 1: | ||
<languages /> | <languages /> | ||
{{ | {{PathNav|Medication/ja|Lipid-lowering agent/ja|frame=1}} | ||
{{Infobox drug | {{Infobox drug | ||
| type = combo | | type = combo | ||
| Line 125: | Line 125: | ||
[[Fish Allergy/ja|魚介類アレルギー]]のある人は特に注意が必要である。また、他のオメガ3脂肪酸と同様に、オメガ3酸エチルエステルを摂取すると、[[anticoagulants/ja|抗凝固薬]]を服用している人は[[bleeding time/ja|出血時間]]が延長するリスクがある。 | [[Fish Allergy/ja|魚介類アレルギー]]のある人は特に注意が必要である。また、他のオメガ3脂肪酸と同様に、オメガ3酸エチルエステルを摂取すると、[[anticoagulants/ja|抗凝固薬]]を服用している人は[[bleeding time/ja|出血時間]]が延長するリスクがある。 | ||
副作用には[[Dyspepsia/ja|胃痛]]、げっぷ、悪味などがあり、臨床試験で非常に高用量(8g/日)を服用した人の中には[[atrial fibrillation/ja|心房細動]]を起こした人もいた。 | |||
オメガ-3酸エチルエステルは妊娠中の女性ではテストされておらず、[[Pregnancy category/ja#United States|妊娠カテゴリーC]]に分類されている。 | |||
==薬理学{{Anchor|Pharmacology}}== | |||
==Pharmacology== | 摂取後、オメガ3酸エチルエステルは、他の食餌性脂肪酸と同様に、そのほとんどが肝臓で代謝される。 | ||
==作用機序{{Anchor|Mechanism of action}}== | |||
==Mechanism of action== | オメガ-3酸エチルエステルは、他のオメガ-3脂肪酸ベースの薬物と同様に、肝臓でのトリグリセリドの産生を減少させ、循環[[very low-density lipoprotein/ja|超低比重リポタンパク質]](VLDL)粒子からのトリグリセリドのクリアランスを促進するようである。その作用機序は明らかではないが、[[beta oxidation/ja|脂肪酸の分解]]の亢進、肝臓でのトリグリセリドの生合成に関与する[[diglyceride acyltransferase/ja|ジグリセリドアシルトランスフェラーゼ]]の阻害、血中の[[lipoprotein lipase/ja|リポ蛋白リパーゼ]]活性の亢進などが考えられる。EPAとDHAはトリグリセリド合成を担う酵素の基質となりにくいため、肝臓でのトリグリセリドの合成は減少する。 | ||
==物理的および化学的特性{{Anchor|Physical and chemical properties}}== | |||
==Physical and chemical properties== | 有効成分は、[[fish oil/ja|魚体油]]を精製して[[esterification/ja|エステル化]]した濃縮オメガ3酸エチルエステルである。Lovaza製品の場合、1000 mgのソフトジェルカプセル1個あたり840 mgのオメガ3脂肪酸:[[eicosapentaenoic acid/ja|イコサペンタエン酸]]エチルエステル(460 mg)と[[docosahexaenoic acid/ja|ドコサヘキサエン酸]]エチルエステル(380 mg)を含む。 | ||
==歴史{{Anchor|History}}== | |||
==History== | プロノバ・バイオファーマ社のルーツはノルウェーの[[Cod liver oil/ja|タラ肝油]]産業である。同社は、1838年にノルウェーのベルゲンで設立されたJCマルテンス社からスピンアウトして1991年に設立された。プロノバ社は、ロバザの[[active pharmaceutical ingredient/ja|医薬品有効成分]]である濃縮オメガ3酸エチルエステル製剤を開発した。 | ||
同社はフランスの[[:en:Laboratoires Pierre Fabre|Pierre Fabre]]のような他の企業と提携した。2004年、プロノバはリライアント・セラピューティクス社(Reliant Therapeutics)に米国とプエルトリコにおける権利をライセンスした。同年、リライアント社とプロノバ社は薬物のFDA承認を獲得し、2005年に米国と欧州で発売された。2005年の世界売上は1億4,400万ドルで、2008年には7億7,800万ドルに達した。 2007年、[[GlaxoSmithKline]]は現金16億5000万ドルでリライアントを買収した。 | |||
2009年、ジェネリック企業の[[Teva Pharmaceuticals]]と[[Par Pharmaceutical]]は、ジェネリック医薬品を上市するために[[Abbreviated New Drug Application/ja|簡略新薬承認申請]](ANDA)を提出する意向を明らかにし、2009年4月、プロノバはロバザをカバーする主要な米国特許であるUS 5,656,667(2017年4月に失効予定)、US 5,502,077(2013年3月に失効予定)を侵害しているとして、両社を提訴した。その後、2012年5月に連邦地裁はこれらの特許は有効であるとしてプロノバ社に有利な判決を下した。ジェネリック企業は控訴したが、2013年9月、米連邦巡回控訴裁判所(以下、CAFC)は、プロノバ社の前身企業が特許を申請する1年以上前に、ロバザに使用されている魚油のサンプルを研究者に送り、試験を行っていたとして、特許を取り消した。したがって、この出来事は、問題の特許を無効にする「公然使用」に該当する。ロバザの[[Generic drug/ja|後発医薬品]]バージョンは2014年4月にアメリカで発売された。 | |||
プロノヴォ社はロバザの成分の製造を続けており、2012年には[[BASF]]が8億4400万ドルでプロノヴァ社を買収すると発表した。買収は2013年に完了した。 | |||
==ブランド名{{Anchor|Brand names}}== | ==ブランド名{{Anchor|Brand names}}== | ||
Latest revision as of 22:14, 15 April 2024
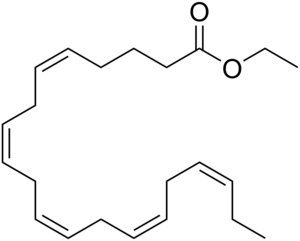 重要なオメガ3酸エチルエステルであるイコサペンタエン酸エチルの化学構造 | |
| Combination of | |
|---|---|
| Eicosapentaenoic acid | 抗脂血症剤 |
| Docosahexaenoic acid | 抗脂血症剤 |
| Clinical data | |
| Trade names | Lovaza, Omtryg, others |
| AHFS/Drugs.com | Monograph |
| License data | |
| Pregnancy category |
|
| Routes of administration | By mouth/ja |
| ATC code |
|
| Legal status | |
| Legal status | |
| Identifiers | |
| CAS Number | |
| DrugBank | |
| UNII | |
| KEGG | |
オメガ3酸エチルエステルとは、オメガ3脂肪酸のエチルエステルであるイコサペンタエン酸エチルとドコサヘキサエン酸エチルの混合物である。魚油に含まれるイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)のエチルエステルである。食生活の改善とともに、これらは高血中トリグリセリドの治療に用いられ、膵炎のリスクを低下させる可能性がある。一般的にスタチンよりも好まれず、NHSスコットランドでは心臓病のリスク低下を支持するエビデンスがないため、使用は推奨されていない。
一般的な副作用には、げっぷ、吐き気、腹部のむかつきなどがある。重篤な副作用としては、肝臓障害やアナフィラキシーがある。妊娠中の使用は十分に研究されていないが、いくつかのオメガ3脂肪酸は有益と思われる。どのように作用するかは完全には明らかになっていない。
オメガ3酸エチルエステル医薬品は、EUでは2000年に、米国では2004年に医療用として承認された。オメガ-3酸エチルエステルは、処方箋による先発医薬品のほか、ジェネリック医薬品や市販薬としても販売されている。2021年には、米国で最も処方されている医薬品の第218位で、処方件数は1 万件を超えた。
医学利用
オメガ-3酸エチルエステルは、重度(≧500 mg/dL)の高トリグリセリド血症の成人において、トリグリセリド値を低下させるために、食事の変更に加えて使用される。欧州連合および米国以外の他の主要市場では、オメガ-3酸エチルエステルは単独で高トリグリセリド血症に、または混合型脂質異常症の患者に対してはスタチンとの併用が適応となっている。
長鎖オメガ-3脂肪酸を処方薬や栄養補助食品として大量(2.0~4.0g/日)に摂取することは、一般的にトリグリセリドを有意に(15%以上)低下させるために必要であり、そのような摂取量では、その効果は有意(20%~35%、500 mg/dLを超える人では45%まで)である可能性がある。 イコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)はともにトリグリセリドを低下させるが、DHAはEPAよりもLDLコレステロールを上昇させ、DHAはHDLコレステロールを上昇させるがEPAは上昇させないようである。
他の魚油ベースの薬物
市販されている他のオメガ3系魚油ベースの処方薬物にも、同様の用途と作用機序がある。
- イコサペンタエン酸エチル(バセパ)。EPAのみのエチルエステル。
- オメガ3カルボン酸(Epanova)。この製品には遊離脂肪酸が含まれており、エチルエステルではない。現在、製造元(アストラゼネカ社)により販売中止となっており、患者は入手できない。アストラゼネカ社は第3相臨床試験を無益であるとして自主的に中止した。
栄養補助食品
多くの魚油サプリメントが市販されている。オメガ3系脂肪酸のトリグリセリド低下作用については、栄養補助食品と処方薬の間にほとんど差はないようだが、エチルエステル製品は空腹時や低脂肪食と一緒に摂取すると効果が低下する。栄養補助食品の成分は、処方薬ほど注意深く管理されておらず、薬物のような臨床試験も行われていない。処方されるオメガ3系サプリメントは、より濃縮されているため、同じ1日摂取量を摂取するのに必要なソフトジェルの数が少なくてすむ。
血液透析を必要とするCKD患者では、血液凝固による血管閉塞によって透析療法ができなくなる危険性がある。オメガ3脂肪酸は、血液凝固を抑えるエイコサノイド分子の産生に寄与する。しかし、2018年に行われたコクランレビューでは、オメガ3サプリメントがCKD患者の血管閉塞予防に何らかの影響を与えるという明確な証拠は見つからなかった。また、サプリメントは12ヵ月以内の入院や死亡を予防しないという中程度の確実性もあった。
副作用
魚介類アレルギーのある人は特に注意が必要である。また、他のオメガ3脂肪酸と同様に、オメガ3酸エチルエステルを摂取すると、抗凝固薬を服用している人は出血時間が延長するリスクがある。
副作用には胃痛、げっぷ、悪味などがあり、臨床試験で非常に高用量(8g/日)を服用した人の中には心房細動を起こした人もいた。
オメガ-3酸エチルエステルは妊娠中の女性ではテストされておらず、妊娠カテゴリーCに分類されている。
薬理学
摂取後、オメガ3酸エチルエステルは、他の食餌性脂肪酸と同様に、そのほとんどが肝臓で代謝される。
作用機序
オメガ-3酸エチルエステルは、他のオメガ-3脂肪酸ベースの薬物と同様に、肝臓でのトリグリセリドの産生を減少させ、循環超低比重リポタンパク質(VLDL)粒子からのトリグリセリドのクリアランスを促進するようである。その作用機序は明らかではないが、脂肪酸の分解の亢進、肝臓でのトリグリセリドの生合成に関与するジグリセリドアシルトランスフェラーゼの阻害、血中のリポ蛋白リパーゼ活性の亢進などが考えられる。EPAとDHAはトリグリセリド合成を担う酵素の基質となりにくいため、肝臓でのトリグリセリドの合成は減少する。
物理的および化学的特性
有効成分は、魚体油を精製してエステル化した濃縮オメガ3酸エチルエステルである。Lovaza製品の場合、1000 mgのソフトジェルカプセル1個あたり840 mgのオメガ3脂肪酸:イコサペンタエン酸エチルエステル(460 mg)とドコサヘキサエン酸エチルエステル(380 mg)を含む。
歴史
プロノバ・バイオファーマ社のルーツはノルウェーのタラ肝油産業である。同社は、1838年にノルウェーのベルゲンで設立されたJCマルテンス社からスピンアウトして1991年に設立された。プロノバ社は、ロバザの医薬品有効成分である濃縮オメガ3酸エチルエステル製剤を開発した。
同社はフランスのPierre Fabreのような他の企業と提携した。2004年、プロノバはリライアント・セラピューティクス社(Reliant Therapeutics)に米国とプエルトリコにおける権利をライセンスした。同年、リライアント社とプロノバ社は薬物のFDA承認を獲得し、2005年に米国と欧州で発売された。2005年の世界売上は1億4,400万ドルで、2008年には7億7,800万ドルに達した。 2007年、GlaxoSmithKlineは現金16億5000万ドルでリライアントを買収した。
2009年、ジェネリック企業のTeva PharmaceuticalsとPar Pharmaceuticalは、ジェネリック医薬品を上市するために簡略新薬承認申請(ANDA)を提出する意向を明らかにし、2009年4月、プロノバはロバザをカバーする主要な米国特許であるUS 5,656,667(2017年4月に失効予定)、US 5,502,077(2013年3月に失効予定)を侵害しているとして、両社を提訴した。その後、2012年5月に連邦地裁はこれらの特許は有効であるとしてプロノバ社に有利な判決を下した。ジェネリック企業は控訴したが、2013年9月、米連邦巡回控訴裁判所(以下、CAFC)は、プロノバ社の前身企業が特許を申請する1年以上前に、ロバザに使用されている魚油のサンプルを研究者に送り、試験を行っていたとして、特許を取り消した。したがって、この出来事は、問題の特許を無効にする「公然使用」に該当する。ロバザの後発医薬品バージョンは2014年4月にアメリカで発売された。
プロノヴォ社はロバザの成分の製造を続けており、2012年にはBASFが8億4400万ドルでプロノヴァ社を買収すると発表した。買収は2013年に完了した。
ブランド名
- ロバザ(米国)/オマコール(欧州)。米国では2004年に承認されている。
- OmtrygはTrygg Pharma社が開発したオメガ3酸エチルエステルの別ブランドで、2004年にFDAに承認された。
- 2016年3月現在、さらに4つのジェネリック医薬品がある。