アテローム
Atheroma/ja
| アテローム | |
|---|---|
| Other names | atheromata (複数形), atheromas (複数形), atheromatous plaque, plaque |
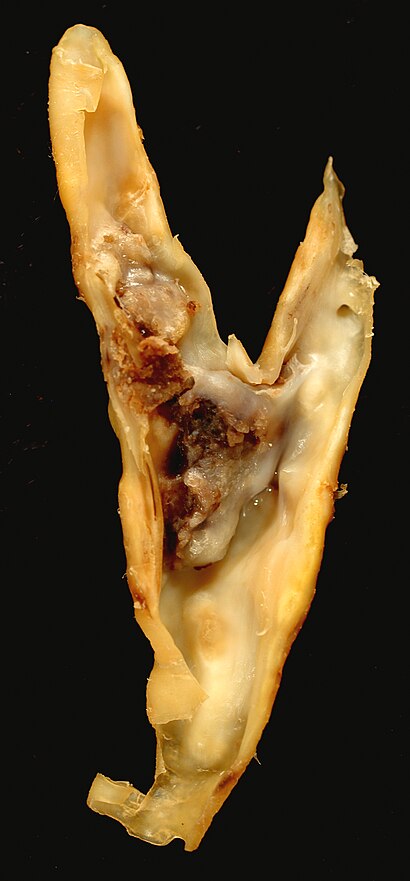 | |
| 頸動脈内膜剥離術標本のアテローム性動脈硬化プラーク。これは共通が内と外側頸動脈に分かれていることを示している。 | |
| Complications | Thrombosis/ja, embolism/ja, atherosclerosis/ja, arteriosclerosis/ja |
| Causes | 高脂血症, hypertriglyceridemia/ja, hypercholesterolemia/ja |
アテロームまたはアテローム性プラークは、動脈壁の内層に異常な物質が蓄積したものである。
この物質は主にマクロファージ細胞、または脂質、カルシウム、および可変量の線維性結合組織を含む残骸から成る。蓄積した物質は動脈壁に腫脹を形成し、動脈の内腔に侵入して狭窄し、血流を制限する。アテロームは動脈硬化症のサブタイプであるアテローム性動脈硬化症の病理学的基礎である。
徴候と症状
ほとんどの人にとって、最初の症状は心臓動脈内のアテロームの進行によるもので、最も一般的には心臓発作とそれに続く衰弱をもたらす。心臓動脈は小さく(約5mmから微細なものまで)、胸の奥深くに隠れており、決して動きを止めないため、追跡は困難である。 さらに、大量に適用される臨床戦略はすべて、最小限のコストと手技の全体的な安全性の両方に重点を置いている。したがって、アテロームを検出し、治療に対する反応を追跡するための既存の診断戦略は極めて限られていた。患者の症状や心臓負荷試験という最も一般的に頼りにされている方法では、粥腫が増加するのに応じて動脈が収縮するのではなく拡大するため、粥腫性疾患が非常に進行するまで問題の症状を検出することができない。プラークが破裂して破片や血栓が生じ、それが下流の血流を阻害し、時には局所的にも(血管造影で見られるように)血流を減少/停止させる。しかし、このような現象は突然起こり、ストレス試験によって事前に明らかにされることはない。
メカニズム
健康な心外膜冠動脈は内膜、中膜、外膜の3層からなる。アテロームと動脈壁の変化は通常、内腔の直径に変化はなく、余分な壁の厚さを補うのに十分な大きさの小さな動脈瘤(拡大)をもたらす。しかし、最終的には、典型的には脆弱プラークの破裂やプラーク上の内腔内の血栓の結果として、血管の狭窄(狭窄)が一部の領域で生じる。頻度は少ないが、動脈が非常に拡大し、その結果、動脈が肉眼的に動脈瘤状に拡大する。この3つの結果は、同一人物内で異なる部位で観察されることが多い。
狭窄と閉塞
時間の経過とともに粥腫の大きさと厚さは増大し、動脈の周囲の筋肉質な中心部(中膜)が伸展する。通常、リモデリングは粥腫の大きさを補うのに十分な程度に起こり、動脈開口部の口径(内腔)は変化しないが、動脈壁断面積の約50%が粥腫組織で構成されるようになる。
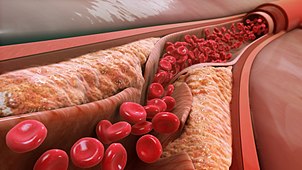
やがて筋壁の肥大がアテローム体積の肥大に追いつかなくなったり、プラーク上に血栓が形成されて組織化したりすると、アテロームと血流を隔てる組織の破裂、血栓、線維化が繰り返される結果、動脈の内腔が狭くなる。この狭窄は、何十年も生きているとより一般的になり、30代から40代になるとますます一般的になる。
内皮(血管の内側にある細胞単層)と線維性被膜と呼ばれる被膜組織が粥腫を内腔の血液から分離している。内皮と線維性被膜の破裂(脆弱性プラークを参照)が起こると、粥腫の内腔に線維性被膜が形成される、 プラークからの破片のシャワー(5マイクロメートル以上の破片は大きすぎて毛細血管を通過できない)と血小板および凝固反応(破片と破裂部位の両方に対する傷害/修復反応)の両方が数分の1秒以内に始まり、最終的に内腔の狭窄、時には閉鎖をもたらす。最終的には、下流の微小血管の閉鎖または閉塞、および/または破裂部における内腔の閉鎖によって下流の組織に損傷が生じ、両者とも下流の組織への血流損失をもたらす。これが心筋梗塞、脳卒中、またはその他の関連する心血管系疾患の主なメカニズムである。
While clots at the rupture site typically shrink in volume over time, some of the clot may become organized into fibrotic tissue resulting in narrowing of the artery lumen; the narrowings sometimes seen on angiography examinations, if severe enough. Since angiography methods can only reveal larger lumens, typically larger than 200 micrometres, angiography after a cardiovascular event commonly does not reveal what happened.
Artery enlargement
If the muscular wall enlargement is overdone over time, then a gross enlargement of the artery results, usually over decades of living. This is a less common outcome. Atheroma within aneurysmal enlargement (vessel bulging) can also rupture and shower debris of atheroma and clot downstream. If the arterial enlargement continues to 2 to 3 times the usual diameter, the walls often become weak enough that with just the stress of the pulse, a loss of wall integrity may occur leading to sudden hemorrhage (bleeding), major symptoms and debility; often rapid death. The main stimulus for aneurysm formation is pressure atrophy of the structural support of the muscle layers. The main structural proteins are collagen and elastin. This causes thinning and the wall balloons allowing gross enlargement to occur, as is common in the abdominal region of the aorta.
Histology
The accumulation (swelling) is always in the tunica intima, between the endothelium lining and the smooth muscle middle layer of the artery wall. While the early stages, based on gross appearance, have traditionally been termed fatty streaks by pathologists, they are not composed of fat cells but of accumulations of white blood cells, especially macrophages, that have taken up oxidized low-density lipoprotein (LDL).
After they accumulate large amounts of cytoplasmic membranes (with associated high cholesterol content) they are called foam cells. When foam cells die, their contents are released, which attracts more macrophages and creates an extracellular lipid core near the centre to inner surface of each atherosclerotic plaque.
Conversely, the outer, older portions of the plaque become more calcified, less metabolically active and more physically stiff over time.
Veins do not develop atheromata, because they are not subjected to the same haemodynamic pressure that arteries are, unless surgically moved to function as an artery, as in bypass surgery.
Diagnosis

Because artery walls enlarge at locations with atheroma, detecting atheroma before death and autopsy has long been problematic at best. Most methods have focused on the openings of arteries; while these methods are highly relevant, they totally miss the atheroma within the arterial lumen.
Historically, arterial wall fixation, staining and thin section has been the gold standard for detection and description of atheroma, after death and autopsy. With special stains and examination, micro calcifications can be detected, typically within smooth muscle cells of the arterial media near the fatty streaks within a year or two of fatty streaks forming.
Interventional and non-interventional methods to detect atherosclerosis, specifically vulnerable plaque (non-occlusive or soft plaque), are widely used in research and clinical practice today.
Carotid Intima-media thickness Scan (CIMT can be measured by B-mode ultrasonography) measurement has been recommended by the American Heart Association as the most useful method to identify atherosclerosis and may now very well be the gold standard for detection.
Intravascular ultrasound is the current most sensitive method detecting and measuring more advanced atheroma within living individuals, but has had limited applications due to cost and body invasiveness.
CT scans using state of the art higher resolution spiral, or the higher speed EBT, machines have been the most effective method for detecting calcification present in plaque. However, the atheroma have to be advanced enough to have relatively large areas of calcification within them to create large enough regions of ~130 Hounsfield units which a CT scanner's software can recognize as distinct from the other surrounding tissues. Typically, such regions start occurring within the heart arteries about 2–3 decades after atheroma start developing. The presence of smaller, spotty plaques may actually be more dangerous for progressing to acute myocardial infarction.
Arterial ultrasound, especially of the carotid arteries, with measurement of the thickness of the artery wall, offers a way to partially track the disease progression. As of 2006, the thickness, commonly referred to as IMT for intimal-medial thickness, is not measured clinically though it has been used by some researchers since the mid-1990s to track changes in arterial walls. Traditionally, clinical carotid ultrasounds have only estimated the degree of blood lumen restriction, stenosis, a result of very advanced disease. The National Institute of Health did a five-year $5 million study, headed by medical researcher Kenneth Ouriel, to study intravascular ultrasound techniques regarding atherosclerotic plaque. More progressive clinicians have begun using IMT measurement as a way to quantify and track disease progression or stability within individual patients.
Angiography, since the 1960s, has been the traditional way of evaluating for atheroma. However, angiography is only motion or still images of dye mixed with the blood within the arterial lumen and never show atheroma; the wall of arteries, including atheroma within the arterial wall remain invisible. The limited exception to this rule is that with very advanced atheroma, with extensive calcification within the wall, a halo-like ring of radiodensity can be seen in most older humans, especially when arterial lumens are visualized end-on. On cine-floro, cardiologists and radiologists typically look for these calcification shadows to recognize arteries before they inject any contrast agent during angiograms.
Classification of lesions
- Type I: Isolated macrophage foam cells
- Type II: Multiple foam cell layers
- Type III: Preatheroma, intermediate lesion
- Type IV: Atheroma
- Type V: Fibroatheroma
- Type VI: Fissured, ulcerated, hemorrhagic, thrombotic lesion
- Type VII: Calcific lesion
- Type VIII: Fibrotic lesion
Treatment
Many approaches have been promoted as methods to reduce or reverse atheroma progression:
- eating a diet of raw fruits, vegetables, nuts, beans, berries, and grains;
- consuming foods containing omega−3 fatty acids such as fish, fish-derived supplements, as well as flax seed oil, borage oil, and other non-animal-based oils;
- abdominal fat reduction;
- aerobic exercise;
- inhibitors of cholesterol synthesis (known as statins);
- low normal blood glucose levels (glycated hemoglobin, also called HbA1c);
- micronutrient (vitamins, potassium, and magnesium) consumption;
- maintaining normal, or healthy, blood pressure levels;
- aspirin supplement
- mouse studies indicated that subcutaneous administration of oligosaccharide 2-hydroxypropyl-β-cyclodextrin (2HPβCD) can solubilize cholesterol, removing it from plaques. However, later work concluded that "treatment with 2HPβCD is ineffective in inducing atherosclerosis regression".
研究の歴史
先進国では、公衆衛生の改善、感染制御、寿命の延長に伴い、アテローム過程は社会にとってますます重要な問題と負担となっている。 アテロームは、1960年代初頭から徐々に改善する傾向にあるにもかかわらず、障害や死亡の主な基礎となっている(患者の年齢で調整)。そのため、この問題をよりよく理解し、治療し、予防するための取り組みが増え続けている。
2004年の米国のデータによると、男性の約65%、女性の約47%において、心血管疾患の最初の症状は心筋梗塞(心臓発作)または突然死(症状発現から1時間以内の死亡)である。
動脈血流障害事象のかなりの割合が50%未満の内腔狭窄部位で起こる。伝統的に血流制限の非侵襲的検査法として最も一般的に行われている心臓負荷試験では、一般的に約75%以上の内腔狭窄しか検出されないが、時には50%以下でも検出できる核負荷試験を提唱する医師もいる。
既存の粥腫、脆弱プラーク(非閉塞性プラークまたはソフトプラーク)の合併症の突然の性質は、1950年代以降、集中治療室や複雑な内科的・外科的介入の開発につながった。狭窄を可視化したり間接的に検出したりするために血管造影やその後の心臓負荷試験が始まった。次にバイパス手術が行われるようになり、移植された静脈、時には動脈を狭窄部の周囲に配管し、最近では血管形成術が行われるようになった。
しかし、このような医療の進歩にもかかわらず、狭心症や血流低下の症状を軽減することに成功したにもかかわらず、アテローム破裂は依然として大きな問題であり、今日どこでも利用可能な最も迅速で大規模かつ熟練した医療・外科的介入にもかかわらず、突然の障害や死に至ることがある。いくつかの臨床試験によると、バイパス手術や血管形成術は、全生存率を改善する効果があったとしても、せいぜいごくわずかである。通常、バイパス手術の死亡率は1~4%、血管形成術の死亡率は1~1.5%である。
加えて、これらの血管インターベンションは、病気が原因で症状が現れ、多くの場合、すでに部分的に障害が残ってから行われることが多い。血管形成術もバイパス術も、将来の心臓発作を予防するものではないことも明らかである。
第二次世界大戦前に遡る、粥腫を理解するための古い方法は、剖検データに依存していた。剖検データは長い間、小児期後半に脂肪縞が発生し、数十年にわたってゆっくりと無症状に進行することを示してきた。
粥腫を見る1つの方法は、非常に侵襲的で費用のかかるIVUS超音波技術である。この技術によって、内膜内部の正確な体積と、動脈の長さの約25 mm (1 in)の中心中膜層が得られる。残念なことに、血管造影では動脈の構造強度に関する情報は得られない。血管造影はアテロームを可視化するものではなく,血管内の血流を可視化するだけである。物理的な侵襲がないか,あるいは少なく,個々の検査あたりの費用が安価な代替法が使用されており,コンピュータ断層撮影法(CT;その高速性から電子線断層撮影法が主導している)や磁気共鳴画像法(MRI)を使用する方法などが開発され続けている。1990年代初頭から最も有望視されているのはEBTであり、ほとんどの人が臨床的に認識される症状や衰弱を来す前に粥腫内の石灰化を検出することができる。スタチン治療(コレステロールを低下させる)は、CTスキャンによって決定される石灰化の速度を遅らせることはない。MRIによる冠動脈血管壁の画像診断は、現在のところ研究的なものに限られているが、無症状の高リスク者において血管壁の肥厚を検出する能力を実証している。非侵襲的で電離放射線を用いないMRIを用いた画像診断法は,将来的には疾患の進行や退縮をモニターするために用いられる可能性がある。ほとんどの可視化技術は研究において使用されているが,ほとんどの患者にとって広く利用できるものではなく,技術的に大きな制約があり,広く受け入れられておらず,一般に医療保険でカバーされていない。
ヒトの臨床試験から、より効果的な治療の焦点は、粥腫の成長過程を遅らせたり、止めたり、さらには部分的に逆転させることであることが次第に明らかになってきた。頸動脈内膜中膜厚(CIMT)と心筋梗塞の直接的な相関を支持した地域社会における動脈硬化リスク(ARIC)研究や心血管健康調査(CHS)などのいくつかの前向き疫学研究がある。ARIC研究は、1987年から1989年にかけて、米国の4つの異なる地域の5歳から65歳の15,792人を対象に実施された。この研究では、ベースラインのCIMTが測定され、頸動脈Bモード超音波検査によって4〜7年間隔で測定が繰り返された。CIMTの増加はCADリスクの増加と相関していた。CHSは1988年に開始され、65歳以下の4,476人を対象にCIMTと心筋梗塞および脳卒中のリスクとの関係が調査された。約6年間の追跡調査終了時、CIMT測定値は心血管イベントと相関していた。
Paroi artérielle et Risque Cardiovasculaire in Asia Africa/Middle East and Latin America(PARC-AALA)も重要な大規模研究であり、アジア、アフリカ、中東、ラテンアメリカの79施設が参加し、異なる民族グループによるCIMTの分布とフラミンガム心血管系スコアとの関連が調査された。重回帰分析により、フラミンガム心血管系スコアの上昇はCIMTと関連し、頸動脈プラークは地理的な差とは無関係であることが明らかになった。
Cahnらは、冠動脈疾患患者152人を頸動脈超音波検査で6〜11ヵ月間前向きに追跡調査し、この期間内に22件の血管イベント(心筋梗塞、一過性脳虚血発作、脳卒中、冠動脈形成術)を認めた。彼らは、この非介入的方法で測定された頸動脈アテローム性動脈硬化症は冠動脈患者の予後診断に重要であると結論した。
ロッテルダム研究において、Botsらは55歳以上の患者7,983人を平均4.6年間追跡し、この期間内に194件の心筋梗塞が発生したことを報告した。CIMTは心筋梗塞群で他の群と比較して有意に高かった。Demircanらは、急性冠症候群患者のCIMTは安定狭心症患者に比べて有意に高いことを明らかにした。
別の研究では、最大CIMT値0.956 mmは血管造影上CADを予測する感度85.7%、特異度85.1%であったと報告されている。研究グループは、安定狭心症の症状を有する循環器科外来に入院した患者であった。その結果、CIMTは重大なCADを有する患者において、重大でない冠動脈病変を有する患者よりも高いことが示された。回帰分析の結果、平均内膜中膜複合体の肥厚が1.0以上であることが有意なCADの予測因子であった。CIMTは冠動脈血管の数が多いほど増加した。文献によると、CIMTはCADの存在下で有意に高いことがわかった。さらに、CIMTは冠動脈に関与する血管の数が増えるにつれて増加し、左冠動脈主幹部が関与する患者で最も高いCIMT値が認められた。しかし、アテロームが無症候性であるために特に研究が困難であることもあり、ヒト臨床試験による臨床的・医学的エビデンスはなかなか得られていない。頸動脈内膜中膜厚スキャン(CIMTはBモード超音波検査で測定可能)、タンパク質を腐食するホモシステインを減少させるビタミンB群、頸部頸動脈プラーク体積と厚さを減少させるビタミンB群、そして末期疾患でも脳卒中を減少させるビタミンB群を用いると、有望な結果が得られている。
さらに、アテローム発生を促進する要因を理解することは、複数の要因が関与する複雑なものであり、リポ蛋白、さらに重要なリポ蛋白サブクラス分析、血糖値、高血圧などの一部のみが最もよく知られ、研究されている。さらに最近では、アテローム進行に関与する固有の炎症マクロファージ誘発過程を促進または抑制する複雑な免疫系パターンのいくつかが、アテローム性動脈硬化症の動物モデルにおいて徐々に解明されつつある。
こちらも参照
さらに読む
- Ornish, D.; Brown, S.E.; Billings, J.H.; Scherwitz, L.W.; Armstrong, W.T.; Ports, T.A.; McLanahan, S.M.; Kirkeeide, R.L.; Gould, K.L.; Brand, R.J. (July 1990). "Can lifestyle changes reverse coronary heart disease?". The Lancet. 336 (8708): 129–133. doi:10.1016/0140-6736(90)91656-u. PMID 1973470. S2CID 4513736.
- Gould, K. Lance; Ornish, D; Scherwitz, L; Brown, S; Edens, RP; Hess, MJ; Mullani, N; Bolomey, L; Dobbs, F; Armstrong, WT (20 September 1995). "Changes in Myocardial Perfusion Abnormalities by Positron Emission Tomography After Long-term, Intense Risk Factor Modification". JAMA. 274 (11): 894–901. doi:10.1001/jama.1995.03530110056036. PMID 7674504.
- Ornish, Dean; Scherwitz, LW; Billings, JH; Brown, SE; Gould, KL; Merritt, TA; Sparler, S; Armstrong, WT; Ports, TA; Kirkeeide, RL; Hogeboom, C; Brand, RJ (16 December 1998). "Intensive Lifestyle Changes for Reversal of Coronary Heart Disease". JAMA. 280 (23): 2001–7. doi:10.1001/jama.280.23.2001. PMID 9863851. S2CID 21508600.
- Ornish, Dean (November 1998). "Avoiding revascularization with lifestyle changes: the multicenter lifestyle demonstration project". The American Journal of Cardiology. 82 (10): 72–76. doi:10.1016/s0002-9149(98)00744-9. PMID 9860380.
- Dod, Harvinder S.; Bhardwaj, Ravindra; Sajja, Venu; Weidner, Gerdi; Hobbs, Gerald R.; Konat, Gregory W.; Manivannan, Shanthi; Gharib, Wissam; Warden, Bradford E.; Nanda, Navin C.; Beto, Robert J.; Ornish, Dean; Jain, Abnash C. (February 2010). "Effect of Intensive Lifestyle Changes on Endothelial Function and on Inflammatory Markers of Atherosclerosis". The American Journal of Cardiology. 105 (3): 362–367. doi:10.1016/j.amjcard.2009.09.038. PMID 20102949.
- Silberman, Anna; Banthia, Rajni; Estay, Ivette S.; Kemp, Colleen; Studley, Joli; Hareras, Dennis; Ornish, Dean (March 2010). "The Effectiveness and Efficacy of an Intensive Cardiac Rehabilitation Program in 24 Sites". American Journal of Health Promotion. 24 (4): 260–266. doi:10.4278/ajhp.24.4.arb. PMID 20232608. S2CID 25915559.
- Glagov, Seymour; Weisenberg, Elliot; Zarins, Christopher K.; Stankunavicius, Regina; Kolettis, George J. (28 May 1987). "Compensatory Enlargement of Human Atherosclerotic Coronary Arteries". New England Journal of Medicine. 316 (22): 1371–1375. doi:10.1056/NEJM198705283162204. PMID 3574413.