Discovery and development of angiotensin receptor blockers/ja: Difference between revisions
Created page with "ARBは治療指数が大きいため、経口バイオアベイラビリティ(ほとんどが低い)は臨床的に重要ではないようである。 表1に見られるように、これらの薬物は血漿蛋白結合性が高いため、1日1回の経口投与で十分な降圧効果が得られるはずである。 経口摂取されたロサルタンの約14%は5-カルボン酸代謝物に..." Tags: Mobile edit Mobile web edit |
Created page with "バルサルタンとオルメサルタンを除くすべてのARBは、ヒトの肝臓に存在するチトクロームP450(CYP)酵素2C9によって何らかの形で代謝される。例えば、CYP2C9はロサルタンをEXP 3174に代謝し、バルサルタンとカンデサルタンを不活性代謝物にゆっくりと代謝する。一方、テルミサルタンの一部はglucuronidation/ja|グルクロ..." Tags: Mobile edit Mobile web edit |
||
| Line 198: | Line 198: | ||
経口摂取されたロサルタンの約14%は5-カルボン酸[[metabolite/ja|代謝物]]に代謝される。EXP3174に代謝される。前述したように、カンデサルタン シレキセチルとオルメサルタン メドキソミルは不活性エステルプロドラッグであり、[[gastrointestinal tract/ja|消化管]]からの[[Absorption (pharmacokinetics)/ja|吸収]]の間に[[esterases/ja|エステラーゼ]]によって完全に加水分解され活性型になる。これらの3つの代謝物は、それらの[[prodrugs/ja|プロドラッグ]]よりも強力なAT<sub>1</sub>受容体拮抗薬である。他のARBには活性代謝物がない。 | 経口摂取されたロサルタンの約14%は5-カルボン酸[[metabolite/ja|代謝物]]に代謝される。EXP3174に代謝される。前述したように、カンデサルタン シレキセチルとオルメサルタン メドキソミルは不活性エステルプロドラッグであり、[[gastrointestinal tract/ja|消化管]]からの[[Absorption (pharmacokinetics)/ja|吸収]]の間に[[esterases/ja|エステラーゼ]]によって完全に加水分解され活性型になる。これらの3つの代謝物は、それらの[[prodrugs/ja|プロドラッグ]]よりも強力なAT<sub>1</sub>受容体拮抗薬である。他のARBには活性代謝物がない。 | ||
バルサルタンとオルメサルタンを除くすべてのARBは、ヒトの肝臓に存在する[[cytochrome P450/ja|チトクロームP450]](CYP)酵素[[CYP2C9/ja|2C9]]によって何らかの形で代謝される。例えば、[[CYP2C9/ja|CYP2C9]]はロサルタンをEXP 3174に代謝し、バルサルタンとカンデサルタンを不活性代謝物にゆっくりと代謝する。一方、テルミサルタンの一部は[[glucuronidation/ja|グルクロン酸抱合]]によって代謝され、オルメサルタンは未変化体の薬物として排泄される。 | |||
テルミサルタンは[[blood–brain barrier/ja|血液脳関門]]を通過できる唯一のARBであるため、AngⅡの中枢性作用を阻害することができ、より優れた血圧コントロールに貢献する。 | |||
<div lang="en" dir="ltr" class="mw-content-ltr"> | <div lang="en" dir="ltr" class="mw-content-ltr"> | ||
Revision as of 12:38, 28 March 2024
アンジオテンシン(AT1)受容体拮抗薬またはサルタンとも呼ばれるアンジオテンシン受容体拮抗薬(ARB)は、体内のホルモンであるアンジオテンシンII(Ang II)の作用を阻害することで作用する降圧薬の一群である。体内のアンジオテンシンII(Ang II)の作用を阻害することで作用し、血圧を低下させる。その構造はAng IIと類似しており、阻害薬としてAng II受容体に結合する〔Rhys HealthcareのT24〕などがある。
ARBは今日の臨床現場で広く使用されている薬物であり、その主な適応症は軽度から中等度の高血圧症、慢性心不全、二次的な脳卒中予防、糖尿病性腎症である。
ARBの発見と開発は、現代の合理的薬物設計の好例であり、生理学的システムの知識を深めるために設計をどのように利用できるかを示すものである。
歴史
1898年、生理学者である ロバート・タイガーシュテットとその弟子のペール・バーグマン(Per Bergman)は、ウサギに腎臓のエキスを注射する実験を行った。その結果、腎臓がレニンと名付けられたタンパク質を生成し、血圧上昇を引き起こすことが示唆された。1930年代、ゴールドブラットはイヌの腎血流を収縮させる実験を行い、虚血腎臓が実際に血管収縮を引き起こす化学物質を分泌していることを発見した。1939年、レニンは血圧上昇の原因ではなく、原因物質であるアンジオテンシンI(Ang I)とAng IIの生成を触媒する酵素であることが判明した。
1970年代、科学者たちはAngⅡが心臓や腎臓に害を及ぼすことを初めて観察し、血漿中のレニン活性が高い人は心筋梗塞や脳卒中のリスクが高いことがわかった。 1970年代後半にアンジオテンシン変換酵素(ACE)阻害薬が登場したことで、AngⅡが血圧や電解質・体液バランスの調節に重要な役割を果たしていることが確認された。
それ以前にも,有用なAng II受容体拮抗薬の開発が試みられており,当初はアンジオテンシンペプチド類似体に主眼が置かれていた。サララシンや他のAng II類似体は強力なAng II受容体遮断薬であったが,主な問題は経口バイオアベイラビリティの欠如であった。
1980年代初頭、一連のイミダゾール-5-酢酸がラットのAng IIに対する血圧応答を低下させることが注目された。誘導体がラットのAng IIに対する血圧応答を低下させることが1980年代に注目された。S-8307とS-8308の2つの化合物は、後に非常に特異的で有望な非ペプチド性のAng II受容体拮抗薬であることがわかったが、分子モデリングを用いて、それらの構造はAng IIのファーマコフォアをより忠実に模倣しなければならないことがわかった。構造的な改良が加えられ,経口活性で強力な選択的非ペプチド性AT1受容体拮抗薬ロサルタンが開発された。1995年にロサルタンは米国で臨床使用が承認され、それ以来さらに6種類のARBが承認されている。これらの薬物はその優れた副作用プロファイルで知られており、臨床試験ではプラセボと同様であることが示されている。
アンジオテンシンII受容体
アンジオテンシンIIの作用はアンジオテンシン受容体、AT1とAT2によって媒介される。これらの受容体は7つの膜貫通型であるGタンパク質共役型受容体ファミリーのメンバーである。細胞外ループと細胞内ループが入れ替わってつながっている。
それぞれのGタンパク質共役型受容体は特定のGタンパク質に結合し、特別なエフェクターシステムの活性化につながる。例えばAT1受容体は主にGq/11グループのGタンパク質を介して結合する。<br さらに2つのアンジオテンシン受容体、AT3とAT4が報告されているが、その役割はまだ不明である。
体内における分布
AT1受容体は主に心臓、副腎、脳、肝臓、腎臓に存在する。その主な役割は、血圧の調節、体液と電解質のバランスの調節である。
AT2受容体は、発育中の胎児では高発現するが、出生後は急速に減少する。成人では、AT2受容体は低レベルでしか存在せず、主に心臓、副腎、子宮、卵巣、腎臓、脳に存在する。
機能
例えば、血管収縮、アルドステロン放出、腎ナトリウム再吸収、バソプレシン分泌などである。AT2受容体も血圧と腎機能の調節に関与するが、AT1受容体と比較して拮抗薬作用を媒介する。
Binding pockets

Ang IIは様々な結合部位を介してAT1受容体に結合する。主な結合部位はAT1受容体の細胞外領域で、Ang IIはAT1受容体のN-末端およびその第1および第3細胞外ループの残基と相互作用する。膜貫通らせんもC末端を介して結合に寄与する。カルボキシル基は受容体の5番らせん上部のLys199と相互作用する。 Lys199とAng IIのPhe8残基のカルボキシル末端基との間に形成されるイオン橋は、Trp253残基によって安定化されている可能性が高い。さらに、膜貫通らせん6のPhe259とAsp263、膜貫通らせん3の外側領域のLys102とSer105もAng IIの結合に関与している。この領域は、受容体の比重の安定化と膜内結合ポケットの形成に関与している可能性がある。
作用機序

血圧や体液・電解質の恒常性は、レニン・アンジオテンシン・アルドステロン系によって調節されている。 腎臓から放出される酵素であるレニンは、不活性な血漿タンパク質アンジオテンシノーゲンをアンジオテンシンI(Ang I)に変換する。 次にAng Iはアンジオテンシン変換酵素(ACE)でAng IIに変換される(図2参照)。その後、血漿中のAng IIはAT受容体に結合する。
ARBはレニン-アンジオテンシン経路の最後の部分を遮断し、ACE阻害薬よりも特異的に経路を遮断する。
AT1受容体はAngⅡを媒介し、心収縮力の亢進、ナトリウム再吸収、血管収縮を引き起こし、これらはすべて血圧上昇につながる。AT1受容体を遮断することで、ARBは血圧を下げる。
AT1受容体の克服不可能な阻害は、AngⅡの濃度がどんなに高くても、ARBの存在下でAngⅡの最大応答を回復できない場合に達成される。 アンジオテンシン受容体拮抗薬は、受容体から解離する速度によって、競合的に克服可能、競合的に克服不可能、または非競合的に受容体を阻害することができる。
薬物の発見と開発
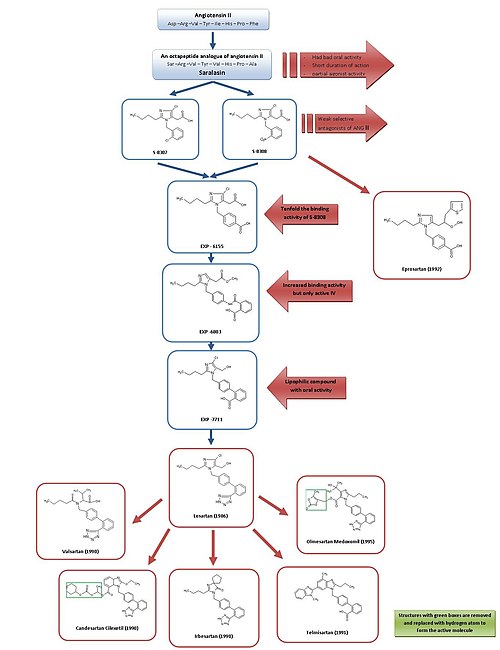
サララシンからロサルタン、エプロサルタンへの発展
ARBの開発の簡単な概要は図3を参照されたい。
最初のAng II拮抗薬であるサララシンと最初のACE阻害薬であるカプトプリルが開発されたため,Ang II受容体拮抗薬が有効な降圧薬として有望である可能性が一般に認められた。
サララシンは1970年代初頭に開発され、Ang IIのオクタペプチドアナログである。Asp1、Ile5、Phe8がそれぞれSer1、Val5、Ala8に置き換えられている。サララシンは経口生物学的利用能がなく、作用時間が短く、部分作動薬活性を示したため、薬物としては適さなかった。
従って、目標は同様の阻害と結合特性を持つ、より小さな非ペプチド物質を開発することであった。この時すでにデュポン社のグループは、化学ライブラリーの既存の物質を用いて、Ang IIの非ペプチド模倣物質のスクリーニングを開始していた。
武田薬品の研究者らは1982年に1-ベンジルイミダゾール-5-酢酸誘導体のグループから弱い非ペプチド性のAng II拮抗薬S-8307とS-8308を発見した。S-8307とS-8308は、中程度の効力、短い作用時間、限られた経口バイオアベイラビリティを持つが、部分作動薬活性を持たない選択的かつ競合的なAT1受容体拮抗薬である。DuPont社のグループは、Ang IIと武田薬品のリード化合物が同じ受容体部位に結合していると仮定した。これら2つの物質は、AT1受容体遮断薬のさらなる最適化のためのリード化合物となった。
DuPontの科学者たちは、Ang IIの空間構造に関する核磁気共鳴研究を用いて、武田薬品の構造体が、より大きなペプチドAng IIにより近くなるように特定の位置を拡大しなければならないことを発見した。
コンピュータ・モデリングを使ってS-8308とS-8307をAng IIと比較したところ、Ang IIにはNH2末端付近に2つの酸性残基があることがわかった。これらの基は武田薬品のリード化合物では模倣されなかったため、酸性官能基を化合物に付加する必要があるという仮説が立てられた
。
4-カルボキシ誘導体であるEXP-6155はS-8308の10倍以上の結合活性を示し、この仮説はさらに強固なものとなった。
4-カルボキシ基を2-カルボキシ-ベンズアミド基で置換することにより、化合物EXP-6803が合成された。この化合物は結合親和性を非常に高めていたが、静脈内投与でのみ活性を示した。
2-カルボキシ-ベンズアミド-基を2-カルボキシ-フェニル-基に置き換えると、親油性のビフェニル-含有EXP-7711ができた。EXP-7711は良好な経口活性を示したが、AT1受容体に対する親和性はわずかに低かった。
その後、極性カルボキシル基をより親油性のテトラゾール基に置換し、経口バイオアベイラビリティと作用時間をさらに向上させ、こうして形成された化合物はロサルタンと命名された。この開発は1986年に行われ、ロサルタンは初めて成功したAng II拮抗薬薬物となり、1995年にアメリカで承認され、Merckによって販売された。
この開発は大規模なプログラムであり、武田薬品の構造から最終的な物質であるロサルタンに至るまでには、生物学的試験や化学的改良に50人年以上の時間を費やしたと推定されている。最近の研究では、欧州連合(EU)におけるロサルタンの投与により、3年半で25億ユーロの医療費削減が可能であると推定されている。
S-8308とは異なるリードを用いて最適化されたエプロサルタンが1992年にSmithKline Beechamによって開発された。エプロサルタンはビフェニルメチル構造を持たないが、Ang IIのC末端を模倣するために、5-酢酸基がa-チエニルアクリル酸と4-カルボキシ基で置換された。エプロサルタンは、選択的、強力かつ競合的なAT1拮抗薬であり、AT1受容体への結合は迅速、可逆的、飽和的であり、親和性が高い。
ロサルタンから他の薬物への発展
ロサルタン、バルサルタン、カンデサルタン、イルベサルタン、テルミサルタン、オルメサルタンはすべてビフェニルメチル基を含む。
ロサルタンはその一部が5-カルボン酸代謝物 EXP 3174となる。EXP3174は、親化合物よりも強力なAT1受容体拮抗薬であり、他のいくつかのARBを開発し続けるモデルとなっている。
バルサルタン、カンデサルタン、イルベサルタンはいずれも1990年に開発された。
Novartisが最初に販売したバルサルタンは、非複素環式ARBである。ロサルタンのイミダゾールをアシル化アミノ酸で置き換えたARBである。
イルベサルタンはSanofiによって開発された。バルサルタンやロサルタンよりも作用時間が長く、ロサルタンのヒドロキシメチル基の代わりにカルボニル基が水素結合受容体として機能するイミダゾリノン環を持つ。イルベサルタンは非競合阻害薬である。
カンデサルタン シレキセチル(TCV 116)は、武田薬品で開発されたベンズイミダゾール系のエステル炭酸塩プロドラッグである。生体内では、より強力な7-カルボン酸カンデサルタンに速やかに変換される。カンデサルタンとAT1受容体との相互作用では、ベンズイミダゾール環のカルボキシル基が重要な役割を果たす。カンデサルタンおよびそのプロドラッグは、EXP3174やロサルタンよりも強い血圧降下作用を有する。
テルミサルタンは1991年にBoehringer Ingelheimによって発見・開発され、ビフェニル酸性基としてカルボン酸を有する。ARBの中で最も消失半減期が長く、約24時間である。
オルメサルタン メドキソミルは1995年に三共によって開発され、2002年に発売された最も新しいARBである。カンデサルタン シレキセチルと同様のエステル型プロドラッグである。生体内では、このプロドラッグは完全かつ速やかに加水分解され、活性酸型のオルメサルタン(RNH-6270)となる。オルメサルタンは、カルボキシル基に加えて、イミダゾール環に結合したヒドロキシイソプロピル基を持つ。
ファーマコフォアと構造活性相関
ファーマコフォア
ARBには3つの官能基がある。
ARBの生理活性にとって最も重要な部分は3つの官能基であり、詳細は図1を参照されたい。
1つ目はイミダゾール環で、ヘリックス7(Asn295)のアミノ酸に結合する。第二の基はビフェニルメチル基で、ヘリックス6と7の両方のアミノ酸に結合する(Phe301、Phe300、Trp253、His256)。3つ目はテトラゾール基で、ヘリックス4と5のアミノ酸(Arg167とLys199)と相互作用する。
テルミサルタンのように、テトラゾール基をカルボン酸基に置き換えることに成功している。
構造活性相関(SAR)
ほとんどのARBは同じファーマコフォアを持っているため、その生化学的効果や生理学的効果の違いは、ほとんどが異なる置換基によるものである。薬物の活性は、基質部位に対する親和性と、その部位に結合する時間の長さに依存する。
イミダゾール環の2位にある直鎖状のアルキル基やビフェニルメチル基のような親油性の置換基は、受容体の疎水性ポケットと結合する。ビフェニルメチル基の1位のテトラゾール、CO2HまたはNHSO2CF3のような酸性基は、受容体の塩基位置に結合し、強力な拮抗薬活性に必要である。
バルサルタンでは、ロサルタンのイミダゾール環がアシル化アミノ酸に置き換えられている
イミダゾール環の4位と5位にはいくつかの置換基が試みられている。ロサルタンのこれらの位置に結合しているクロロ基とヒドロキシメチル基は、他のARBがこれらの官能基を持たず、ロサルタンと同等かそれ以上の結合親和性を持つことから、受容体結合においてあまり重要ではないと考えられる。イルベサルタンは5位にカルボニル基を持ち、ロサルタンのヒドロキシメチル基の代わりに水素結合受容体として機能するため、受容体への結合が長くなる。<その結果、受容体への結合時間が長くなる。
エプロサルタンの構造は他のARBと最も異なっており、通常のビフェニルメチル基はカルボキシベンジル基に置き換えられており、Ang IIのTyr4基のフェノール部分をより忠実に模倣している。この変更により、受容体への結合はより強くなるが、生化学的・生理学的効果は有意には改善されない。
テルミサルタンはビフェニルメチル基の2位にカルボン酸を持ち、テトラゾールアナログよりも強力である。<br
また、4位と5位にヒドロキシメチル基とカルボキシ基を有するイミダゾールは、ヒドロキシメチル基の水素結合と親水性により強力な拮抗作用を有することが報告されている
また、イミダゾール環上の4位のヒドロキシ基は、結合親和性に重要な役割を果たし、嵩高いアルキル基の親油性の欠点を補うことも報告されている
これらの結果は、CHMeOHやCMe2OHのような中程度の大きさのヒドロキシアルキル基が、イミダゾール環上の4位の置換基として好ましいことを示している。さらに、イオン化可能な基は結合親和性に有利である。
AT1受容体に対する親和性はカンデサルタンとオルメサルタンが最も高く、次いでイルベサルタンとエプロサルタンである。バルサルタン、テルミサルタン、EXP3174は、カンデサルタンより約10倍低い親和性である。ロサルタンは最も親和性が低い。ARBのAT2受容体に対する親和性は、一般にAT1サブタイプに対する親和性よりもはるかに低い(または約10,000倍低い)。従って、ARBはAT2レセプターを妨げることなく刺激することができる。
薬物の比較と薬物動態
| 薬剤 | 生物学的半減期 [h] | タンパク質結合率 [%] | 生物学的利用能 [%] | 腎/肝クリアランス [%] | 食物の影響 | 容量/日 [mg] |
|---|---|---|---|---|---|---|
| ロサルタン | 2 | 98.7 | 33 | 10/90 | ミネラル | 50-100 |
| EXP 3174/ja | 6-9 | 99.8 | - | 50/50 | - | - |
| Candesartan/ja | 9 | >99 | 15 | 60/40 | No | 4-32 |
| Valsartan/ja | 6 | 95 | 25 | 30/70 | 40-50% 減少 | 80-320 |
| Irbesartan/ja | 11-15 | 90-95 | 70 | 1/99 | なし | 150-300 |
| テルミサルタン | 24 | >99 | 42-58 | 1/99 | なし | 40-80 |
| Eprosartan/ja | 5 | 98 | 13 | 30/70 | なし | 400-800 |
| Olmesartan/ja | 14-16 | >99 | 29 | 40/60 | なし | 10-40 |
| 情報源: | ||||||
ARBは治療指数が大きいため、経口バイオアベイラビリティ(ほとんどが低い)は臨床的に重要ではないようである。 表1に見られるように、これらの薬物は血漿蛋白結合性が高いため、1日1回の経口投与で十分な降圧効果が得られるはずである。 経口摂取されたロサルタンの約14%は5-カルボン酸代謝物に代謝される。EXP3174に代謝される。前述したように、カンデサルタン シレキセチルとオルメサルタン メドキソミルは不活性エステルプロドラッグであり、消化管からの吸収の間にエステラーゼによって完全に加水分解され活性型になる。これらの3つの代謝物は、それらのプロドラッグよりも強力なAT1受容体拮抗薬である。他のARBには活性代謝物がない。
バルサルタンとオルメサルタンを除くすべてのARBは、ヒトの肝臓に存在するチトクロームP450(CYP)酵素2C9によって何らかの形で代謝される。例えば、CYP2C9はロサルタンをEXP 3174に代謝し、バルサルタンとカンデサルタンを不活性代謝物にゆっくりと代謝する。一方、テルミサルタンの一部はグルクロン酸抱合によって代謝され、オルメサルタンは未変化体の薬物として排泄される。 テルミサルタンは血液脳関門を通過できる唯一のARBであるため、AngⅡの中枢性作用を阻害することができ、より優れた血圧コントロールに貢献する。
All of the ARBs have the same mechanism of action and differences in their potency can be related to their different pharmacokinetic profiles. A few clinical head-to-head comparisons have been made and candesartan, irbesartan and telmisartan appear to be slightly more effective than losartan in lowering blood pressure. This difference may be related to different strengths of activity at the receptor level, such as duration and strength of receptor binding.
開発中のARB

いくつかの新しい非ペプチドARBが臨床試験中であるか,前臨床段階にある。これらの中には、エンブサルタン(BAY 10-6734またはBAY 10-6734)、KRH-594、フォンサルタン(HR 720)、およびプラトサルタン(KT3-671)がある。例えばプラトサルタンは、イミダゾール環にオキソ部分(C=O)が融合した7員環という新しい構造を持ち(図4)、AT1受容体に対する親和性はロサルタンの約7倍である。このオキソ基の目的は、他のARBのカルボン酸基と同様である。 テルミサルタンの脂質代謝や糖代謝に対するプラスの効果や、ロサルタンの尿酸値を下げる効果など、ARBの他の特性も研究されている。このような効果は、これらの薬物の新たな適応につながるかもしれないが、さらなる研究が必要である。