Atheroma/ja: Difference between revisions
Created page with "==治療== {{Anchor|Treatment}} 粥腫の進行を抑制または逆転させる方法として、多くのアプローチが推進されてきた: * 生の果物、野菜、ナッツ類、豆類、ベリー類、穀類を食べる * 魚や魚由来のサプリメント、亜麻仁油、ボラージオイルなど、動物性でないオメガ3脂肪酸を含む食品を摂取する * 腹部脂肪を減らす * 有酸素運動 * cholesterol/ja|コレ..." |
|||
| (20 intermediate revisions by the same user not shown) | |||
| Line 27: | Line 27: | ||
この物質は主に[[macrophage/ja|マクロファージ細胞]]、または[[lipids/ja|脂質]]、カルシウム、および可変量の線維性[[connective tissue/ja|結合組織]]を含む残骸から成る。蓄積した物質は動脈壁に腫脹を形成し、動脈の[[Lumen (anatomy)/ja|内腔]]に侵入して[[stenosis/ja|狭窄]]し、血流を制限する。アテロームは[[arteriosclerosis/ja|動脈硬化症]]のサブタイプである[[atherosclerosis/ja|アテローム性動脈硬化症]]の[[pathological/ja|病理学的]]基礎である。 | この物質は主に[[macrophage/ja|マクロファージ細胞]]、または[[lipids/ja|脂質]]、カルシウム、および可変量の線維性[[connective tissue/ja|結合組織]]を含む残骸から成る。蓄積した物質は動脈壁に腫脹を形成し、動脈の[[Lumen (anatomy)/ja|内腔]]に侵入して[[stenosis/ja|狭窄]]し、血流を制限する。アテロームは[[arteriosclerosis/ja|動脈硬化症]]のサブタイプである[[atherosclerosis/ja|アテローム性動脈硬化症]]の[[pathological/ja|病理学的]]基礎である。 | ||
==徴候と症状== | |||
{{Anchor|Signs and symptoms}} | |||
ほとんどの人にとって、最初の症状は[[coronary arteries/ja|心臓動脈]]内のアテロームの進行によるもので、最も一般的には[[myocardial infarction/ja|心臓発作]]とそれに続く衰弱をもたらす。心臓動脈は小さく(約5mmから微細なものまで)、胸の奥深くに隠れており、決して動きを止めないため、追跡は困難である。 さらに、大量に適用される臨床戦略はすべて、最小限のコストと手技の全体的な安全性の両方に重点を置いている。したがって、アテロームを検出し、治療に対する反応を追跡するための既存の診断戦略は極めて限られていた。患者の症状や[[cardiac stress testing/ja|心臓負荷試験]]という最も一般的に頼りにされている方法では、粥腫が増加するのに応じて動脈が収縮するのではなく拡大するため、粥腫性疾患が非常に進行するまで問題の症状を検出することができない。プラークが破裂して破片や血栓が生じ、それが下流の血流を阻害し、時には局所的にも([[angiogram/ja|血管造影]]で見られるように)血流を減少/停止させる。しかし、このような現象は突然起こり、[[Cardiac stress test/ja|ストレス試験]]によって事前に明らかにされることはない。 | |||
==メカニズム== | |||
{{Anchor|Mechanism}} | |||
健康な心外膜冠動脈は[[tunica intima/ja|内膜]]、中膜、[[adventitia/ja|外膜]]の3層からなる。アテロームと動脈壁の変化は通常、内腔の直径に変化はなく、余分な壁の厚さを補うのに十分な大きさの小さな[[aneurysm/ja|動脈瘤]](拡大)をもたらす。しかし、最終的には、典型的には[[vulnerable plaque/ja|脆弱プラーク]]の破裂やプラーク上の内腔内の血栓の結果として、血管の[[stenosis/ja|狭窄]](狭窄)が一部の領域で生じる。頻度は少ないが、動脈が非常に拡大し、その結果、動脈が肉眼的に動脈瘤状に拡大する。この3つの結果は、同一人物内で異なる部位で観察されることが多い。 | |||
===狭窄と閉塞=== | |||
時間の経過とともに粥腫の大きさと厚さは増大し、[[artery/ja|動脈]]の周囲の筋肉質な中心部(中膜)が伸展する。通常、リモデリングは粥腫の大きさを補うのに十分な程度に起こり、動脈開口部の[[Caliber/ja|口径]]([[Lumen (anatomy)/ja|内腔]])は変化しないが、動脈壁断面積の約50%が粥腫組織で構成されるようになる。 | |||
[[File:Atheroma.jpg|thumb|302x302px|粥腫で閉塞した狭窄動脈血管(想像図)。]] | |||
[[File:Atheroma.jpg|thumb|302x302px| | やがて筋壁の肥大がアテローム体積の肥大に追いつかなくなったり、プラーク上に血栓が形成されて組織化したりすると、アテロームと血流を隔てる組織の破裂、血栓、線維化が繰り返される結果、動脈の内腔が狭くなる。この狭窄は、何十年も生きているとより一般的になり、30代から40代になるとますます一般的になる。 | ||
[[endothelium/ja|内皮]](血管の内側にある細胞単層)と[[fibrous cap/ja|線維性被膜]]と呼ばれる被膜組織が粥腫を内腔の血液から分離している。内皮と線維性被膜の破裂([[vulnerable plaque/ja|脆弱性プラーク]]を参照)が起こると、粥腫の内腔に線維性被膜が形成される、 プラークからの破片のシャワー(5マイクロメートル以上の破片は大きすぎて[[capillary/ja|毛細血管]]を通過できない)と[[platelet/ja|血小板]]および[[clotting/ja|凝固]]反応(破片と破裂部位の両方に対する傷害/修復反応)の両方が数分の1秒以内に始まり、最終的に内腔の狭窄、時には閉鎖をもたらす。最終的には、下流の微小血管の閉鎖または閉塞、および/または破裂部における内腔の閉鎖によって下流の組織に損傷が生じ、両者とも下流の組織への血流損失をもたらす。これが[[myocardial infarction/ja|心筋梗塞]]、[[stroke/ja|脳卒中]]、またはその他の関連する[[cardiovascular disease/ja|心血管系疾患]]の主なメカニズムである。 | |||
破裂部位の血栓は通常、時間の経過とともに体積が縮小するが、血栓の一部は線維組織に組織化され、動脈内腔の狭窄をもたらすことがある。血管造影法では、一般的に200マイクロメートル以上の大きな内腔しか確認できないため、心血管系イベント後の血管造影では、何が起こったのかを明らかにできないことが一般的である。 | |||
===動脈拡大=== | |||
== | 筋壁の肥大が長期間にわたって過剰に進行した場合、通常は数十年以上にわたって、動脈の肉眼的な[[aneurysm/ja|拡大]]が生じる。これはあまり一般的な結果ではない。動脈瘤拡大(血管の膨らみ)内のアテロームも破裂し、アテロームの破片や血栓を下流に流すことがある。動脈瘤が通常の直径の2~3倍まで拡大すると、壁が十分に弱くなることが多く、脈拍のストレスだけで壁の完全性が失われ、突然の[[hemorrhage/ja|出血]]、重大な症状、衰弱に至ることがある。動脈瘤形成の主な刺激は、筋層の構造的支持の圧力萎縮である。主な構造蛋白は[[collagen/ja|コラーゲン]]と[[elastin/ja|エラスチン]]である。その原因で血管の壁が薄くなり、膨らみが生じる。これは腹部大動脈で一般的に見られる現象である。 | ||
==組織学== | |||
{{Anchor|Histology}} | |||
蓄積(腫脹)は常に動脈壁の[[endothelium/ja|内皮]]内層と平滑筋[[tunica media/ja|中層]]の間の'''内膜'''に生じる。肉眼的外観に基づく初期段階は、病理学者によって伝統的に[[fatty streaks/ja|脂肪線条]]と呼ばれてきたが、それらは[[fat cells/ja|脂肪細胞]]から構成されているのではなく、酸化された[[low-density lipoprotein/ja|低比重リポ蛋白]](LDL)を取り込んだ[[white blood cells/ja|白血球]]、特に[[macrophages/ja|マクロファージ]]の蓄積から構成されている。 | |||
細胞質膜が大量に蓄積されると(それに伴ってコレステロール含量が高くなる)、それらは[[foam cell/ja|泡沫細胞]]と呼ばれる。泡沫細胞が死滅すると、その内容物が放出され、より多くのマクロファージを引き寄せ、それぞれのアテローム性動脈硬化プラークの中心から内面付近に細胞外脂質のコアを形成する。 | |||
逆に、プラークの外側の古い部分は、時間の経過とともに石灰化が進み、代謝活性が低下し、物理的に硬くなる。 | |||
[[Coronary artery bypass surgery/ja|バイパス術]]のように外科的に動脈として機能するように移動させない限り、[[vein/ja|静脈]]は動脈と同じような血行力学的圧力を受けないため、アテロームが形成されることはない。 | |||
==診断== | |||
{{Anchor|Diagnosis}} | |||
[[File:Blausen 0052 Artery NormalvPartially-BlockedVessel.png|thumb| | [[File:Blausen 0052 Artery NormalvPartially-BlockedVessel.png|thumb|正常血管とアテローム性動脈硬化プラークによる部分的閉塞血管を比較したイラスト。血管が拡大し、内腔の狭窄があまりないことに注目されたい。]] | ||
動脈壁は粥腫のある場所で拡大するため、死亡前や剖検前に粥腫を検出することは長い間、よくて問題であった。ほとんどの方法は動脈の開口部に焦点を当てている。これらの方法は非常に適切であるが、動脈管腔内のアテロームを見逃している。 | |||
歴史的には、動脈壁の固定、染色および薄切片が、死後および剖検後のアテロームの検出と記述のためのゴールドスタンダードであった。特殊な染色と検査により、微小な石灰化を検出することができ、典型的には、脂肪縞が形成されてから1、2年以内に脂肪縞に近い動脈中膜の平滑筋細胞内に検出される。 | |||
アテローム性動脈硬化症、特に'''[[vulnerable plaque/ja|脆弱プラーク]]'''(非閉塞性プラークまたはソフトプラーク)を検出するための介入的および非介入的方法は、今日、研究および臨床で広く用いられている。 | |||
[[Carotid/ja|頸動脈]][[Intima-media thickness/ja|内膜中膜厚]]スキャン(CIMTはBモード[[ultrasonography/ja|超音波検査]]で測定できる)測定は、アテローム性動脈硬化症を同定するための最も有用な方法として[[:en:American Heart Association|米国心臓協会]]によって推奨されており、現在では検出のためのゴールドスタンダードとなっている。 | |||
[[Carotid]] [[Intima-media thickness]] | |||
[[Intravascular ultrasound/ja|血管内超音波]]は、生きている個体内でより進行したアテロームを検出し測定する、現在最も感度の高い方法であるが、コストと身体への侵襲性のために、その応用は限られていた。 | |||
[[Intravascular ultrasound]] | |||
プラーク内に存在する石灰化を検出するためには、最新の高分解能スパイラル[[CT scan/ja|CTスキャン]]または高速の[[Electron beam tomography/ja|EBT]]装置を用いたCTスキャンが最も効果的な方法である。しかし、CTスキャナーのソフトウェアが他の周辺組織と区別して認識できるような、~130[[:en:Hounsfield scale|Hounsfield単位]]の十分な大きさの領域を形成するためには、アテロームが十分に進行し、その中に比較的大きな石灰化領域がなければならない。通常、このような領域は粥腫が発生し始めてから約2~30年後に心臓動脈内で発生し始める。小さい斑点状のプラークが存在することは、急性[[myocardial infarction/ja|心筋梗塞]]に進行する危険性が高い。 | |||
[[CT scan]] | |||
動脈超音波検査、特に[[carotid/ja|頸動脈]]の動脈壁の厚さの測定は、疾患の進行を部分的に追跡する方法を提供する。2006年現在、一般的に内膜-内膜厚のIMTと呼ばれる厚さは臨床的には測定されていないが、1990年代半ばから一部の研究者により動脈壁の変化を追跡するために使用されている。伝統的に、臨床的な頸動脈超音波検査は、非常に進行した疾患の結果である血液内腔制限の程度、[[stenosis/ja|狭窄]]のみを推定してきた。[[:en:National Institute of Health|国立衛生研究所]]は[[medical research/ja|医学研究]]者である[[:en:Kenneth Ouriel|Kenneth Ouriel]]を責任者として、アテローム性動脈硬化プラークに関する血管内超音波技術を研究するために、5年間で500万ドルの研究を行った。より進歩的な臨床医は、個々の患者における疾患の進行や安定性を定量化し追跡する方法として、IMT測定を使用し始めている。 | |||
1960年代以来、[[Angiography/ja|血管造影]]はアテロームを評価する伝統的な方法であった。しかし、血管造影は動脈[[Lumen (anatomy)/ja|内腔]]内の血液と混ざった色素の動画または静止画のみであり、アテロームは決して映らない。この規則に対する限られた例外は、壁内の広範な石灰化を伴う非常に進行した粥腫で、特に動脈腔を端から端まで可視化した場合、ほとんどの高齢者において放射性密度のハロー状のリングが見られることである。シネフロでは、心臓専門医や放射線科医は通常、血管造影の際に[[contrast agent/ja|造影剤]]を注入する前に、動脈を認識するためにこのような石灰化の影を探す。 | |||
[[Angiography]] | |||
===病変の分類=== | |||
* タイプI:孤立したマクロファージ泡沫細胞 | |||
* | * タイプII:複数の泡沫細胞層 | ||
* | * タイプIII:泡沫細胞、中間病変 | ||
* | * タイプIV:アテローム | ||
* | * タイプV: 線維性アテローム | ||
* | * タイプVI:亀裂、潰瘍、出血、血栓性病変 | ||
* | * タイプVII:石灰化病変 | ||
* | * タイプVIII:線維性病変 | ||
* | |||
==治療== | |||
{{Anchor|Treatment}} | |||
粥腫の進行を抑制または逆転させる方法として、多くのアプローチが推進されてきた: | |||
* | * 生の果物、野菜、ナッツ類、豆類、ベリー類、穀類を食べる | ||
* | * 魚や魚由来のサプリメント、亜麻仁油、ボラージオイルなど、動物性でない[[omega−3/ja|オメガ3]]脂肪酸を含む食品を摂取する | ||
* | * 腹部脂肪を減らす | ||
* | * 有酸素運動 | ||
* | * [[cholesterol/ja|コレステロール]]合成の阻害剤([[statins/ja|スタチン]]として知られている) | ||
* | * 正常な[[blood glucose/ja|血糖値]]が低い([[glycated hemoglobin/ja|糖化ヘモグロビン]]、[[HbA1c/ja|HbA1c]]とも呼ばれる); | ||
* | * 微量栄養素(ビタミン、[[potassium/ja|カリウム]]、[[magnesium/ja|マグネシウム]])の摂取; | ||
* | * 血圧を正常値あるいは健康な値に維持する; | ||
* | * アスピリンサプリメント | ||
* | * [[cyclodextrin/ja|オリゴ糖2-ヒドロキシプロピル-β-シクロデキストリン]](2HPβCD)の皮下投与は[[cholesterol/ja|コレステロール]]を可溶化し、プラークから除去することができることがマウスの研究で示された。しかし、後の研究では「2HPβCDによる治療は動脈硬化の退縮を誘導するのに有効ではない」と結論づけられた。 | ||
==研究の歴史== | ==研究の歴史== | ||
Latest revision as of 12:28, 8 March 2024
| アテローム | |
|---|---|
| Other names | atheromata (複数形), atheromas (複数形), atheromatous plaque, plaque |
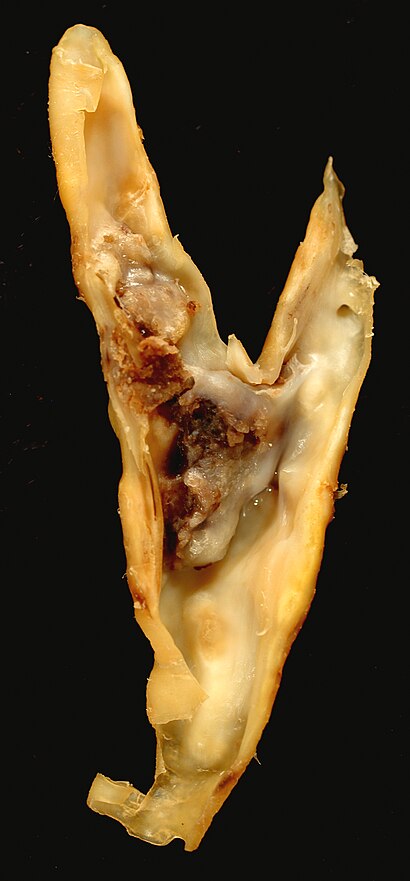 | |
| 頸動脈内膜剥離術標本のアテローム性動脈硬化プラーク。これは共通が内と外側頸動脈に分かれていることを示している。 | |
| Complications | Thrombosis/ja, embolism/ja, atherosclerosis/ja, arteriosclerosis/ja |
| Causes | 高脂血症, hypertriglyceridemia/ja, hypercholesterolemia/ja |
アテロームまたはアテローム性プラークは、動脈壁の内層に異常な物質が蓄積したものである。
この物質は主にマクロファージ細胞、または脂質、カルシウム、および可変量の線維性結合組織を含む残骸から成る。蓄積した物質は動脈壁に腫脹を形成し、動脈の内腔に侵入して狭窄し、血流を制限する。アテロームは動脈硬化症のサブタイプであるアテローム性動脈硬化症の病理学的基礎である。
徴候と症状
ほとんどの人にとって、最初の症状は心臓動脈内のアテロームの進行によるもので、最も一般的には心臓発作とそれに続く衰弱をもたらす。心臓動脈は小さく(約5mmから微細なものまで)、胸の奥深くに隠れており、決して動きを止めないため、追跡は困難である。 さらに、大量に適用される臨床戦略はすべて、最小限のコストと手技の全体的な安全性の両方に重点を置いている。したがって、アテロームを検出し、治療に対する反応を追跡するための既存の診断戦略は極めて限られていた。患者の症状や心臓負荷試験という最も一般的に頼りにされている方法では、粥腫が増加するのに応じて動脈が収縮するのではなく拡大するため、粥腫性疾患が非常に進行するまで問題の症状を検出することができない。プラークが破裂して破片や血栓が生じ、それが下流の血流を阻害し、時には局所的にも(血管造影で見られるように)血流を減少/停止させる。しかし、このような現象は突然起こり、ストレス試験によって事前に明らかにされることはない。
メカニズム
健康な心外膜冠動脈は内膜、中膜、外膜の3層からなる。アテロームと動脈壁の変化は通常、内腔の直径に変化はなく、余分な壁の厚さを補うのに十分な大きさの小さな動脈瘤(拡大)をもたらす。しかし、最終的には、典型的には脆弱プラークの破裂やプラーク上の内腔内の血栓の結果として、血管の狭窄(狭窄)が一部の領域で生じる。頻度は少ないが、動脈が非常に拡大し、その結果、動脈が肉眼的に動脈瘤状に拡大する。この3つの結果は、同一人物内で異なる部位で観察されることが多い。
狭窄と閉塞
時間の経過とともに粥腫の大きさと厚さは増大し、動脈の周囲の筋肉質な中心部(中膜)が伸展する。通常、リモデリングは粥腫の大きさを補うのに十分な程度に起こり、動脈開口部の口径(内腔)は変化しないが、動脈壁断面積の約50%が粥腫組織で構成されるようになる。
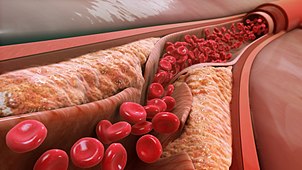
やがて筋壁の肥大がアテローム体積の肥大に追いつかなくなったり、プラーク上に血栓が形成されて組織化したりすると、アテロームと血流を隔てる組織の破裂、血栓、線維化が繰り返される結果、動脈の内腔が狭くなる。この狭窄は、何十年も生きているとより一般的になり、30代から40代になるとますます一般的になる。
内皮(血管の内側にある細胞単層)と線維性被膜と呼ばれる被膜組織が粥腫を内腔の血液から分離している。内皮と線維性被膜の破裂(脆弱性プラークを参照)が起こると、粥腫の内腔に線維性被膜が形成される、 プラークからの破片のシャワー(5マイクロメートル以上の破片は大きすぎて毛細血管を通過できない)と血小板および凝固反応(破片と破裂部位の両方に対する傷害/修復反応)の両方が数分の1秒以内に始まり、最終的に内腔の狭窄、時には閉鎖をもたらす。最終的には、下流の微小血管の閉鎖または閉塞、および/または破裂部における内腔の閉鎖によって下流の組織に損傷が生じ、両者とも下流の組織への血流損失をもたらす。これが心筋梗塞、脳卒中、またはその他の関連する心血管系疾患の主なメカニズムである。
破裂部位の血栓は通常、時間の経過とともに体積が縮小するが、血栓の一部は線維組織に組織化され、動脈内腔の狭窄をもたらすことがある。血管造影法では、一般的に200マイクロメートル以上の大きな内腔しか確認できないため、心血管系イベント後の血管造影では、何が起こったのかを明らかにできないことが一般的である。
動脈拡大
筋壁の肥大が長期間にわたって過剰に進行した場合、通常は数十年以上にわたって、動脈の肉眼的な拡大が生じる。これはあまり一般的な結果ではない。動脈瘤拡大(血管の膨らみ)内のアテロームも破裂し、アテロームの破片や血栓を下流に流すことがある。動脈瘤が通常の直径の2~3倍まで拡大すると、壁が十分に弱くなることが多く、脈拍のストレスだけで壁の完全性が失われ、突然の出血、重大な症状、衰弱に至ることがある。動脈瘤形成の主な刺激は、筋層の構造的支持の圧力萎縮である。主な構造蛋白はコラーゲンとエラスチンである。その原因で血管の壁が薄くなり、膨らみが生じる。これは腹部大動脈で一般的に見られる現象である。
組織学
蓄積(腫脹)は常に動脈壁の内皮内層と平滑筋中層の間の内膜に生じる。肉眼的外観に基づく初期段階は、病理学者によって伝統的に脂肪線条と呼ばれてきたが、それらは脂肪細胞から構成されているのではなく、酸化された低比重リポ蛋白(LDL)を取り込んだ白血球、特にマクロファージの蓄積から構成されている。
細胞質膜が大量に蓄積されると(それに伴ってコレステロール含量が高くなる)、それらは泡沫細胞と呼ばれる。泡沫細胞が死滅すると、その内容物が放出され、より多くのマクロファージを引き寄せ、それぞれのアテローム性動脈硬化プラークの中心から内面付近に細胞外脂質のコアを形成する。
逆に、プラークの外側の古い部分は、時間の経過とともに石灰化が進み、代謝活性が低下し、物理的に硬くなる。
バイパス術のように外科的に動脈として機能するように移動させない限り、静脈は動脈と同じような血行力学的圧力を受けないため、アテロームが形成されることはない。
診断

動脈壁は粥腫のある場所で拡大するため、死亡前や剖検前に粥腫を検出することは長い間、よくて問題であった。ほとんどの方法は動脈の開口部に焦点を当てている。これらの方法は非常に適切であるが、動脈管腔内のアテロームを見逃している。
歴史的には、動脈壁の固定、染色および薄切片が、死後および剖検後のアテロームの検出と記述のためのゴールドスタンダードであった。特殊な染色と検査により、微小な石灰化を検出することができ、典型的には、脂肪縞が形成されてから1、2年以内に脂肪縞に近い動脈中膜の平滑筋細胞内に検出される。
アテローム性動脈硬化症、特に脆弱プラーク(非閉塞性プラークまたはソフトプラーク)を検出するための介入的および非介入的方法は、今日、研究および臨床で広く用いられている。
頸動脈内膜中膜厚スキャン(CIMTはBモード超音波検査で測定できる)測定は、アテローム性動脈硬化症を同定するための最も有用な方法として米国心臓協会によって推奨されており、現在では検出のためのゴールドスタンダードとなっている。
血管内超音波は、生きている個体内でより進行したアテロームを検出し測定する、現在最も感度の高い方法であるが、コストと身体への侵襲性のために、その応用は限られていた。
プラーク内に存在する石灰化を検出するためには、最新の高分解能スパイラルCTスキャンまたは高速のEBT装置を用いたCTスキャンが最も効果的な方法である。しかし、CTスキャナーのソフトウェアが他の周辺組織と区別して認識できるような、~130Hounsfield単位の十分な大きさの領域を形成するためには、アテロームが十分に進行し、その中に比較的大きな石灰化領域がなければならない。通常、このような領域は粥腫が発生し始めてから約2~30年後に心臓動脈内で発生し始める。小さい斑点状のプラークが存在することは、急性心筋梗塞に進行する危険性が高い。
動脈超音波検査、特に頸動脈の動脈壁の厚さの測定は、疾患の進行を部分的に追跡する方法を提供する。2006年現在、一般的に内膜-内膜厚のIMTと呼ばれる厚さは臨床的には測定されていないが、1990年代半ばから一部の研究者により動脈壁の変化を追跡するために使用されている。伝統的に、臨床的な頸動脈超音波検査は、非常に進行した疾患の結果である血液内腔制限の程度、狭窄のみを推定してきた。国立衛生研究所は医学研究者であるKenneth Ourielを責任者として、アテローム性動脈硬化プラークに関する血管内超音波技術を研究するために、5年間で500万ドルの研究を行った。より進歩的な臨床医は、個々の患者における疾患の進行や安定性を定量化し追跡する方法として、IMT測定を使用し始めている。
1960年代以来、血管造影はアテロームを評価する伝統的な方法であった。しかし、血管造影は動脈内腔内の血液と混ざった色素の動画または静止画のみであり、アテロームは決して映らない。この規則に対する限られた例外は、壁内の広範な石灰化を伴う非常に進行した粥腫で、特に動脈腔を端から端まで可視化した場合、ほとんどの高齢者において放射性密度のハロー状のリングが見られることである。シネフロでは、心臓専門医や放射線科医は通常、血管造影の際に造影剤を注入する前に、動脈を認識するためにこのような石灰化の影を探す。
病変の分類
- タイプI:孤立したマクロファージ泡沫細胞
- タイプII:複数の泡沫細胞層
- タイプIII:泡沫細胞、中間病変
- タイプIV:アテローム
- タイプV: 線維性アテローム
- タイプVI:亀裂、潰瘍、出血、血栓性病変
- タイプVII:石灰化病変
- タイプVIII:線維性病変
治療
粥腫の進行を抑制または逆転させる方法として、多くのアプローチが推進されてきた:
- 生の果物、野菜、ナッツ類、豆類、ベリー類、穀類を食べる
- 魚や魚由来のサプリメント、亜麻仁油、ボラージオイルなど、動物性でないオメガ3脂肪酸を含む食品を摂取する
- 腹部脂肪を減らす
- 有酸素運動
- コレステロール合成の阻害剤(スタチンとして知られている)
- 正常な血糖値が低い(糖化ヘモグロビン、HbA1cとも呼ばれる);
- 微量栄養素(ビタミン、カリウム、マグネシウム)の摂取;
- 血圧を正常値あるいは健康な値に維持する;
- アスピリンサプリメント
- オリゴ糖2-ヒドロキシプロピル-β-シクロデキストリン(2HPβCD)の皮下投与はコレステロールを可溶化し、プラークから除去することができることがマウスの研究で示された。しかし、後の研究では「2HPβCDによる治療は動脈硬化の退縮を誘導するのに有効ではない」と結論づけられた。
研究の歴史
先進国では、公衆衛生の改善、感染制御、寿命の延長に伴い、アテローム過程は社会にとってますます重要な問題と負担となっている。 アテロームは、1960年代初頭から徐々に改善する傾向にあるにもかかわらず、障害や死亡の主な基礎となっている(患者の年齢で調整)。そのため、この問題をよりよく理解し、治療し、予防するための取り組みが増え続けている。
2004年の米国のデータによると、男性の約65%、女性の約47%において、心血管疾患の最初の症状は心筋梗塞(心臓発作)または突然死(症状発現から1時間以内の死亡)である。
動脈血流障害事象のかなりの割合が50%未満の内腔狭窄部位で起こる。伝統的に血流制限の非侵襲的検査法として最も一般的に行われている心臓負荷試験では、一般的に約75%以上の内腔狭窄しか検出されないが、時には50%以下でも検出できる核負荷試験を提唱する医師もいる。
既存の粥腫、脆弱プラーク(非閉塞性プラークまたはソフトプラーク)の合併症の突然の性質は、1950年代以降、集中治療室や複雑な内科的・外科的介入の開発につながった。狭窄を可視化したり間接的に検出したりするために血管造影やその後の心臓負荷試験が始まった。次にバイパス手術が行われるようになり、移植された静脈、時には動脈を狭窄部の周囲に配管し、最近では血管形成術が行われるようになった。
しかし、このような医療の進歩にもかかわらず、狭心症や血流低下の症状を軽減することに成功したにもかかわらず、アテローム破裂は依然として大きな問題であり、今日どこでも利用可能な最も迅速で大規模かつ熟練した医療・外科的介入にもかかわらず、突然の障害や死に至ることがある。いくつかの臨床試験によると、バイパス手術や血管形成術は、全生存率を改善する効果があったとしても、せいぜいごくわずかである。通常、バイパス手術の死亡率は1~4%、血管形成術の死亡率は1~1.5%である。
加えて、これらの血管インターベンションは、病気が原因で症状が現れ、多くの場合、すでに部分的に障害が残ってから行われることが多い。血管形成術もバイパス術も、将来の心臓発作を予防するものではないことも明らかである。
第二次世界大戦前に遡る、粥腫を理解するための古い方法は、剖検データに依存していた。剖検データは長い間、小児期後半に脂肪縞が発生し、数十年にわたってゆっくりと無症状に進行することを示してきた。
粥腫を見る1つの方法は、非常に侵襲的で費用のかかるIVUS超音波技術である。この技術によって、内膜内部の正確な体積と、動脈の長さの約25 mm (1 in)の中心中膜層が得られる。残念なことに、血管造影では動脈の構造強度に関する情報は得られない。血管造影はアテロームを可視化するものではなく,血管内の血流を可視化するだけである。物理的な侵襲がないか,あるいは少なく,個々の検査あたりの費用が安価な代替法が使用されており,コンピュータ断層撮影法(CT;その高速性から電子線断層撮影法が主導している)や磁気共鳴画像法(MRI)を使用する方法などが開発され続けている。1990年代初頭から最も有望視されているのはEBTであり、ほとんどの人が臨床的に認識される症状や衰弱を来す前に粥腫内の石灰化を検出することができる。スタチン治療(コレステロールを低下させる)は、CTスキャンによって決定される石灰化の速度を遅らせることはない。MRIによる冠動脈血管壁の画像診断は、現在のところ研究的なものに限られているが、無症状の高リスク者において血管壁の肥厚を検出する能力を実証している。非侵襲的で電離放射線を用いないMRIを用いた画像診断法は,将来的には疾患の進行や退縮をモニターするために用いられる可能性がある。ほとんどの可視化技術は研究において使用されているが,ほとんどの患者にとって広く利用できるものではなく,技術的に大きな制約があり,広く受け入れられておらず,一般に医療保険でカバーされていない。
ヒトの臨床試験から、より効果的な治療の焦点は、粥腫の成長過程を遅らせたり、止めたり、さらには部分的に逆転させることであることが次第に明らかになってきた。頸動脈内膜中膜厚(CIMT)と心筋梗塞の直接的な相関を支持した地域社会における動脈硬化リスク(ARIC)研究や心血管健康調査(CHS)などのいくつかの前向き疫学研究がある。ARIC研究は、1987年から1989年にかけて、米国の4つの異なる地域の5歳から65歳の15,792人を対象に実施された。この研究では、ベースラインのCIMTが測定され、頸動脈Bモード超音波検査によって4〜7年間隔で測定が繰り返された。CIMTの増加はCADリスクの増加と相関していた。CHSは1988年に開始され、65歳以下の4,476人を対象にCIMTと心筋梗塞および脳卒中のリスクとの関係が調査された。約6年間の追跡調査終了時、CIMT測定値は心血管イベントと相関していた。
Paroi artérielle et Risque Cardiovasculaire in Asia Africa/Middle East and Latin America(PARC-AALA)も重要な大規模研究であり、アジア、アフリカ、中東、ラテンアメリカの79施設が参加し、異なる民族グループによるCIMTの分布とフラミンガム心血管系スコアとの関連が調査された。重回帰分析により、フラミンガム心血管系スコアの上昇はCIMTと関連し、頸動脈プラークは地理的な差とは無関係であることが明らかになった。
Cahnらは、冠動脈疾患患者152人を頸動脈超音波検査で6〜11ヵ月間前向きに追跡調査し、この期間内に22件の血管イベント(心筋梗塞、一過性脳虚血発作、脳卒中、冠動脈形成術)を認めた。彼らは、この非介入的方法で測定された頸動脈アテローム性動脈硬化症は冠動脈患者の予後診断に重要であると結論した。
ロッテルダム研究において、Botsらは55歳以上の患者7,983人を平均4.6年間追跡し、この期間内に194件の心筋梗塞が発生したことを報告した。CIMTは心筋梗塞群で他の群と比較して有意に高かった。Demircanらは、急性冠症候群患者のCIMTは安定狭心症患者に比べて有意に高いことを明らかにした。
別の研究では、最大CIMT値0.956 mmは血管造影上CADを予測する感度85.7%、特異度85.1%であったと報告されている。研究グループは、安定狭心症の症状を有する循環器科外来に入院した患者であった。その結果、CIMTは重大なCADを有する患者において、重大でない冠動脈病変を有する患者よりも高いことが示された。回帰分析の結果、平均内膜中膜複合体の肥厚が1.0以上であることが有意なCADの予測因子であった。CIMTは冠動脈血管の数が多いほど増加した。文献によると、CIMTはCADの存在下で有意に高いことがわかった。さらに、CIMTは冠動脈に関与する血管の数が増えるにつれて増加し、左冠動脈主幹部が関与する患者で最も高いCIMT値が認められた。しかし、アテロームが無症候性であるために特に研究が困難であることもあり、ヒト臨床試験による臨床的・医学的エビデンスはなかなか得られていない。頸動脈内膜中膜厚スキャン(CIMTはBモード超音波検査で測定可能)、タンパク質を腐食するホモシステインを減少させるビタミンB群、頸部頸動脈プラーク体積と厚さを減少させるビタミンB群、そして末期疾患でも脳卒中を減少させるビタミンB群を用いると、有望な結果が得られている。
さらに、アテローム発生を促進する要因を理解することは、複数の要因が関与する複雑なものであり、リポ蛋白、さらに重要なリポ蛋白サブクラス分析、血糖値、高血圧などの一部のみが最もよく知られ、研究されている。さらに最近では、アテローム進行に関与する固有の炎症マクロファージ誘発過程を促進または抑制する複雑な免疫系パターンのいくつかが、アテローム性動脈硬化症の動物モデルにおいて徐々に解明されつつある。
こちらも参照
さらに読む
- Ornish, D.; Brown, S.E.; Billings, J.H.; Scherwitz, L.W.; Armstrong, W.T.; Ports, T.A.; McLanahan, S.M.; Kirkeeide, R.L.; Gould, K.L.; Brand, R.J. (July 1990). "Can lifestyle changes reverse coronary heart disease?". The Lancet. 336 (8708): 129–133. doi:10.1016/0140-6736(90)91656-u. PMID 1973470. S2CID 4513736.
- Gould, K. Lance; Ornish, D; Scherwitz, L; Brown, S; Edens, RP; Hess, MJ; Mullani, N; Bolomey, L; Dobbs, F; Armstrong, WT (20 September 1995). "Changes in Myocardial Perfusion Abnormalities by Positron Emission Tomography After Long-term, Intense Risk Factor Modification". JAMA. 274 (11): 894–901. doi:10.1001/jama.1995.03530110056036. PMID 7674504.
- Ornish, Dean; Scherwitz, LW; Billings, JH; Brown, SE; Gould, KL; Merritt, TA; Sparler, S; Armstrong, WT; Ports, TA; Kirkeeide, RL; Hogeboom, C; Brand, RJ (16 December 1998). "Intensive Lifestyle Changes for Reversal of Coronary Heart Disease". JAMA. 280 (23): 2001–7. doi:10.1001/jama.280.23.2001. PMID 9863851. S2CID 21508600.
- Ornish, Dean (November 1998). "Avoiding revascularization with lifestyle changes: the multicenter lifestyle demonstration project". The American Journal of Cardiology. 82 (10): 72–76. doi:10.1016/s0002-9149(98)00744-9. PMID 9860380.
- Dod, Harvinder S.; Bhardwaj, Ravindra; Sajja, Venu; Weidner, Gerdi; Hobbs, Gerald R.; Konat, Gregory W.; Manivannan, Shanthi; Gharib, Wissam; Warden, Bradford E.; Nanda, Navin C.; Beto, Robert J.; Ornish, Dean; Jain, Abnash C. (February 2010). "Effect of Intensive Lifestyle Changes on Endothelial Function and on Inflammatory Markers of Atherosclerosis". The American Journal of Cardiology. 105 (3): 362–367. doi:10.1016/j.amjcard.2009.09.038. PMID 20102949.
- Silberman, Anna; Banthia, Rajni; Estay, Ivette S.; Kemp, Colleen; Studley, Joli; Hareras, Dennis; Ornish, Dean (March 2010). "The Effectiveness and Efficacy of an Intensive Cardiac Rehabilitation Program in 24 Sites". American Journal of Health Promotion. 24 (4): 260–266. doi:10.4278/ajhp.24.4.arb. PMID 20232608. S2CID 25915559.
- Glagov, Seymour; Weisenberg, Elliot; Zarins, Christopher K.; Stankunavicius, Regina; Kolettis, George J. (28 May 1987). "Compensatory Enlargement of Human Atherosclerotic Coronary Arteries". New England Journal of Medicine. 316 (22): 1371–1375. doi:10.1056/NEJM198705283162204. PMID 3574413.