ニコチンアミドリボシド
| |

| |
| Names | |
|---|---|
| IUPAC name
3-Carbamoyl-1-(β-D-ribofuranosyl)pyridin-1-ium
| |
| Systematic IUPAC name
3-Carbamoyl-1-[(2R,3R,4S,5R)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]pyridin-1-ium | |
| Other names
1-(β-D-Ribofuranosyl)nicotinamide; N-Ribosylnicotinamide
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
PubChem CID
|
|
| UNII | |
| |
| |
| Properties | |
| C11H15N2O5+ | |
| Molar mass | 255.25 g/mol |
ニコチンアミドリボシド(NR、SR647)は、ピリジン-ヌクレオシドの一種で、ビタミンB3の一種である。ニコチンアミドアデニンジヌクレオチド、またはNAD+の前駆体として機能する。
化学
ニコチンアミドリボシドの分子量が255.25g/molであるのに対し、塩化物塩の分子量は290.70g/molである。そのため、100 mgの塩化ニコチンアミドリボシドは88 mgのニコチンアミドリボシドを提供する。
歴史
ニコチンアミドリボシド(NR)は、細菌と真核生物の両方においてサルベージNAD合成に関与するNAD前駆体として同定されている。 細菌では、1944年にインフルエンザ菌の培養に必要な増殖因子として初めて報告され、インフルエンザ菌は増殖するためにX因子(ヘミン)とV因子(NAD)の両方を必要とすることが同定された。 血液から精製されたV因子は、ニコチンアミドアデニンジヌクレオチド(NAD+)、NMN、NRの3つの形態で存在することが示された。 NRはインフルエンザ菌を最も急速に増殖させた化合物であった。
インフルエンザ菌はニコチン酸(NA)、ニコチンアミド(NAM)、トリプトファン(Trp)やアスパラギン酸(Asp)のようなアミノ酸では増殖できない。 インフルエンザ菌は、環境中の他の細胞からのNAD前駆体のサルベージに完全に依存している。
真核生物におけるNAD前駆体としてのニコチンアミドリボシド(NR)の同定は、ペラグラの研究から発展した。ペラグラはNAD+欠乏に関連する最初の疾患であった。1914年にジョセフ・ゴールドバーガーによって栄養欠乏と関連づけられ、1937年にはコンラッド・エルヴェヘムによってナイアシン(ビタミンB3)の欠乏と関連づけられた。 ペラグラの症例ではNAD+(当時は補酵素Iと呼ばれていた)が極端に低下していることが示され、NAとNAMがNAD+レベルを回復させる分子前駆体として同定された。ペラグラは現在、NAD+の深刻な慢性的枯渇として理解されており、食事療法によって治療することができる。
NAD+代謝に関するその後の研究により、NAD+の利用可能性を維持するために細胞や組織が用いる調節経路が同定された。NAD+とその前駆体であるニコチン酸(NA)およびニコチンアミド(NAM)は、細胞内の酸化/還元反応およびATP合成において重要な補因子であることが示されている。 真核生物で特徴づけられる古典的なNAD+合成経路には、Trpからの8段階のde novo経路と、NAD+前駆体であるNAとNAMを用いる2つの経路がある:Preiss-Handler経路として知られるNAベースの3段階経路と、酵素ニコチンアミドホスホリボシルトランスフェラーゼ(NAMPT)とニコチンアミドモノヌクレオチド(NMN)の形成を含むNAMベースの経路である。
2004年、ニコチンアミドリボシド(NR)が真核生物における追加のNAD+前駆体として同定されたとき、これまで知られていなかった経路が報告された。 NRは現在ではビタミンB3の一種として認識されており、牛乳にもヒトの母乳にも含まれている。 細胞内に取り込まれると、NRはニコチンアミドリボシドキナーゼ酵素(NRK1とNRK2)の活性によって速やかにリン酸化され、ニコチンアミドモノヌクレオチド(NMN)を形成する。 NMNはその後、NMN-アデニル基転移酵素(NMNAT)によってNAD+に変換される。
哺乳類における研究によると、NRK1は細胞質タンパク質であり、Nmrk1遺伝子によってコードされている。ほとんどの組織に存在するが、主に肝臓と腎臓に多い。NRK2タンパク質は心筋を含む筋肉組織に関係している可能性がある。これはNmrk2遺伝子によってコードされ、代謝ストレスや細胞損傷の場合に、より高発現するようである。 組織の種類によってNRとNRKの濃度が異なるため、NRの利用も組織によって異なると考えられる。
代謝研究により、かつては安定分子と考えられていたNAD+は、代謝のホメオスタシスを維持するために厳密な調節が必要なほど、絶えず入れ替わり使用されていることが示されている。 哺乳類におけるNRの利用には、外因性の食物源と、中間体を再利用する内因性のサルベージ過程の両方が関与している可能性がある。 NR代謝とさまざまなNAD+経路の相互作用については、現在も研究が続けられている。NAM経路とNR経路はアミド基を伴い、「アミド化」経路と呼ばれる。トリプトファンからの新たな合成経路とNAのサルベージからの経路は脱アミノ酸経路であり、律速アミド化酵素NADsynthase1(NADSYN)を共有している。NAD+代謝の障害や不均衡は多くの疾患で観察されており、NAD+前駆体を投与することでNAD+レベルを回復させる可能性は、研究者の関心の的である。
生合成
ニコチンアミドリボシド(NR)は現在、NAD+前駆体であることが知られており、ビタミンB3をNAD+に変換する生合成経路に関与している。NAD+は哺乳類では主にトリプトファンからデノボで合成され、ニコチン酸(NA)からPriess-Handler経路を経て、あるいはニコチンアミド(NAM)からサルベージ経路を経て合成される。
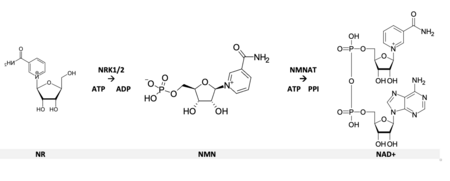
ニコチンアミドリボシド(NR)は、ニコチンアミドリボシドキナーゼ酵素(NRK1およびNRK2)によるリン酸化を含む付加的な経路を経て利用される。酵母では、NRはヌクレオシダーゼPnp1、Urh1、Meu1によって分解された後、Preiss-Handler経路とニコチンアミダーゼPnc1の作用によってNAD⁺に変換されることも示されている。
商業化
2012年7月にChromaDexが特許をライセンスし、NRをTruNiagenとして市場に出すためのプロセス開発を開始した。ChromaDex社は2016年以来、ニコチンアミドリボシドサプリメントの権利をめぐってElysium Health社と特許紛争を続けている。
安全性に関する指定
2016年、米国食品医薬品局(FDA)は、塩化ニコチンアミドリボシド(NRC、Niagen™)の製剤について、クロマデックスにGenerally recognized as safe(GRAS)ステータスを付与した。2015年と2017年に米国食品医薬品局から栄養補助食品に使用する新規栄養成分(NDI)に指定された。2018年にはカナダ保健省の認可天然健康製品データベース(LNHPD)に登録された。 欧州連合(EU)は2019年付けで、規則(EU)2015/2283に基づき、NRCに新規食品としての「新規栄養成分」指定を与えた。2020年にはEUにより食品サプリメントへの使用が認可された。EFSAの栄養、新規食品および食品アレルゲンに関するパネル(NDA)は、2021年時点で、成人における特別医療目的食品(FSMP)および体重コントロールのための総合栄養食(TDRWC)への使用については純粋なニコチンアミドと同程度に安全であるとみなしたが、その他のいくつかの使用については安全性を確立するためにさらなる調査が必要であると指摘した。 オーストラリア政府は、TGA(オーストラリア医薬品庁)の組成ガイドラインに基づき、塩化ニコチンアミドリボシドをポジティブリストに指定した。