シタグリプチン
Sitagliptin/ja
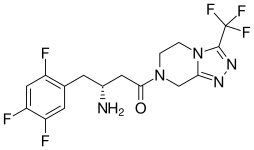 | |
 | |
| Clinical data | |
|---|---|
| Pronunciation | /sɪtəˈɡlɪptɪn/ ( |
| Trade names | Januvia, Zituvio, others |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a606023 |
| License data |
|
| Pregnancy category |
|
| Routes of administration | 経口 |
| ATC code | |
| Legal status | |
| Legal status | |
| Pharmacokinetic data | |
| Bioavailability | 87% |
| Protein binding | 38% |
| Metabolism | 肝臓 (CYP3A4- と CYP2C8-介在) |
| Elimination half-life | 8 to 14 h |
| Excretion | Kidney/ja (80%) |
| Identifiers | |
| |
| CAS Number | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Chemical and physical data | |
| Formula | C16H15F6N5O |
| Molar mass | 407.320 g·mol−1 |
| 3D model (JSmol) | |
| |
| |
| (verify) | |
シタグリプチン(sitagliptin, ブランド名ジャヌビア他)は、2型糖尿病の治療に用いられる抗糖尿病薬である。イギリスではメトホルミンやスルホニルウレアよりも優先度が低いとされている。口から服用する。また、合剤医薬品シタグリプチン/メトホルミン(ジャヌメット、ジャヌメットXR)もある。
一般的な副作用には、頭痛、脚の腫れ、上気道感染症などがある。重篤な副作用には、血管浮腫、低血糖、腎障害、膵炎、関節痛などがある。妊娠中や授乳中の使用が安全かどうかは不明である。ジペプチジルペプチダーゼ-4(DPP-4)阻害薬クラスに属し、膵臓によるインスリンの産生を増加させ、グルカゴンの産生を減少させることで作用する。
シタグリプチンはMerck & Co.によって開発され、2006年に米国で医薬品として承認された。2021年には、米国で83番目に多く処方された医薬品であり、8 万以上の処方があった。カナダではジェネリック医薬品として販売されているが、米国では販売されていない。
医薬用途
シタグリプチンは2型糖尿病の治療に用いられる。一般的にメトホルミンやスルホニル尿素よりも好まれない。経口で服用する。また、シタグリプチン/メトホルミン(ジャヌメット、ジャヌメットXR)とシタグリプチン/シンバスタチン(ジュビシンク)の合剤としても利用できる。
シタグリプチンは1型糖尿病の治療に用いるべきではない。2020年12月、米国食品医薬品局(FDA)は、ジャヌビア(シタグリプチン)、ジャヌメット(シタグリプチンおよびメトホルミン塩酸塩)、ジャヌメットXR(シタグリプチンおよびメトホルミン塩酸塩徐放製剤)は、10~17歳の2型糖尿病の小児の血糖(血糖値)コントロールを改善することは証明されていないとの表示変更を承認した。これらの薬物は、18歳以上の成人2型糖尿病患者の血糖コントロールを改善する目的で承認されている。
副作用
シタグリプチンによる副作用は、まれに吐き気、感冒様症状、光線過敏症を除き、プラセボと同様である。シタグリプチンは下痢のリスクを増加させない。低血糖の発現には、プラセボとシタグリプチンとの間に有意差は存在しない。スルホニルウレアを服用している患者では、低血糖のリスクが高まる。
まれに腎不全や過敏反応の症例報告があることは、米国の処方情報に記載されているが、シタグリプチンの因果関係は確立されていない。
シタグリプチンおよび他のDPP-4阻害薬で治療された患者において、いくつかの市販後報告で膵炎(一部は致死的)が報告されており、米国の添付文書にはその旨の警告が記載されているが、シタグリプチンと膵炎の因果関係はまだ完全には立証されていない。2009年に発表された実験用ラットを用いたある研究では、メトホルミンと併用した場合、膵炎や膵癌の可能性のあるリスクの一部が減少する可能性があると結論づけている。しかし、DPP-4阻害薬はそのような危険因子の増加を示したが、2009年現在、DPP-4阻害薬を服用している人に膵臓癌の増加は報告されていない。
2015年、米国食品医薬品局(FDA)は、すべてのDPP-4阻害薬のラベルに、「重篤で障害をもたらす」関節痛のリスクに関する新たな警告と注意書きを追加した。
作用機序
Sitagliptin works to competitively inhibit the enzyme dipeptidyl peptidase 4 (DPP-4). This enzyme breaks down the incretins GLP-1 and GIP, gastrointestinal hormones released in response to a meal. By preventing breakdown of GLP-1 and GIP, they are able to increase the secretion of insulin and suppress the release of glucagon by the alpha cells of the pancreas. This drives blood glucose levels towards normal. As the blood glucose level approaches normal, the amounts of insulin released and glucagon suppressed diminishes, thus tending to prevent an "overshoot" and subsequent low blood sugar (hypoglycemia), which is seen with some other oral hypoglycemic agents.
Sitagliptin has been shown to lower HbA1c level by about 0.7% points versus placebo. It is slightly less effective than metformin when used as a monotherapy. It does not cause weight gain and has less hypoglycemia compared to sulfonylureas. Sitagliptin is recommended as a second-line drug (in combination with other drugs) after the combination of diet/exercise and metformin fails.
歴史
シタグリプチンは2006年10月に米国食品医薬品局(FDA)によって承認され、米国ではMerck & Co.からジャヌビアとして販売されている。2007年4月2日、FDAはシタグリプチン/メトホルミンの経口配合剤を承認し、米国ではジャヌメットの商品名で販売されている。2011年10月7日、FDAは米国でJuvisyncとして販売されているシタグリプチン/シンバスタチンの経口配合剤を承認した。