Flavin adenine dinucleotide/ja: Difference between revisions
Created page with "=== 酸化還元 ===" Tags: Mobile edit Mobile web edit |
Created page with "=== 光遺伝学 === オプトジェネティクスは、非侵襲的な方法で生物学的事象を制御することを可能にする。 この分野は近年、青色光利用FADドメイン(BLUF)のような光感受性を引き起こすものを含む、多くの新しいツールによって進歩している。 BLUFは植物やバクテリアの光受容体に由来する100から140アミノ酸の配列をコードし..." Tags: Mobile edit Mobile web edit |
||
| (5 intermediate revisions by the same user not shown) | |||
| Line 181: | Line 181: | ||
グルタミン酸合成酵素は、L-グルタミンを窒素源として、2-オキソグルタル酸からL-グルタミン酸への変換を触媒する。全てのグルタミン酸合成酵素は、鉄-硫黄クラスターとFMNを含む鉄-硫黄フラボ蛋白質である。グルタミン酸合成の3つのクラスは、その配列と生化学的性質に基づいて分類される。この酵素には3つのクラスがあるとはいえ、最初にFMNを還元するものが異なるだけで、すべて同じメカニズムで作動すると考えられている。1つはグルタミンの加水分解(グルタミン酸とアンモニアを形成)により、もう1つは最初の反応から生じたアンモニアが2-オキソグルタル酸を攻撃することにより、FMNによってグルタミン酸に還元される。 | グルタミン酸合成酵素は、L-グルタミンを窒素源として、2-オキソグルタル酸からL-グルタミン酸への変換を触媒する。全てのグルタミン酸合成酵素は、鉄-硫黄クラスターとFMNを含む鉄-硫黄フラボ蛋白質である。グルタミン酸合成の3つのクラスは、その配列と生化学的性質に基づいて分類される。この酵素には3つのクラスがあるとはいえ、最初にFMNを還元するものが異なるだけで、すべて同じメカニズムで作動すると考えられている。1つはグルタミンの加水分解(グルタミン酸とアンモニアを形成)により、もう1つは最初の反応から生じたアンモニアが2-オキソグルタル酸を攻撃することにより、FMNによってグルタミン酸に還元される。 | ||
< | <span id="Clinical_significance"></span> | ||
== | == 臨床的意義 == | ||
{{Anchor|Clinical significance}} | |||
< | <span id="Flavoprotein-related_diseases"></span> | ||
=== | === フラボタンパク質関連疾患 === | ||
[[flavoprotein/ja|フラボタンパク質]]の重要性から、ヒトのフラボタンパク質の約60%が変異するとヒトの病気を引き起こすことは当然である。場合によっては、FADまたはFMNに対する[[ligand (biochemistry)/ja#Receptor/ligand binding affinity|親和性]]が低下するため、リボフラビンの過剰摂取が[[Glutaric acidemia type 2/ja|多重アシル-CoAデヒドロゲナーゼ欠損症]]のような疾患症状を軽減することがある。さらに、リボフラビン欠乏症そのもの(およびその結果生じるFADとFMNの欠乏)が健康問題を引き起こすこともある。例えば、[[Amyotrophic lateral sclerosis/ja|ALS]]患者では、FAD合成のレベルが低下している。これらの経路はどちらも、発育や胃腸の異常、誤った[[Fatty acid metabolism/ja|脂肪分解]]、[[anemia/ja|貧血]]、神経学的問題、[[cancer/ja|癌]]や[[Cardiovascular disease/ja|心臓病]]、[[偏頭痛]]、視力の悪化、皮膚病変など、さまざまな症状を引き起こす。そのため製薬業界は、特定の場合に食事を補うためにリボフラビンを製造している。 2008年、リボフラビンの世界的ニーズは年間6,000トンで、生産能力は10,000トンであった。この1億5,000万ドルから5億ドルの市場は、医療用途だけでなく、農業分野では動物性食品の補助食品として、また[[Food coloring/ja|食用色素]]としても使用されている。 | |||
< | <span id="Drug_design"></span> | ||
=== | === 薬物デザイン === | ||
一般的な抗生物質に対する耐性菌が増加する中、抗細菌医薬品の新たな[[drug design/ja|デザイン]]は科学研究において引き続き重要である。 FADを使用する特定の代謝タンパク質([[succinate dehydrogenase/ja|複合体II]])は細菌の病原性に不可欠であるため、FAD合成を標的にしたり、FADアナログを作ったりすることは有用な研究分野となりうる。すでに科学者たちは、FADが結合すると通常とる2つの構造を決定している。1つは伸長したコンフォメーション、もう1つはバタフライコンフォメーションで、このコンフォメーションでは分子が実質的に半分に折れ曲がり、アデニン環とイソアロキサジン環が積み重なる。 同様の方法で結合できるが、タンパク質の機能を阻害しないFAD模倣体は、細菌感染を阻害する有用なメカニズムとなりうる。ヒトと細菌のFAD合成は非常に異なる酵素に依存しているため、細菌のFAD合成酵素を標的にした薬物がヒトのFAD合成酵素を阻害する可能性は低い。 | |||
=== 光遺伝学 === | |||
[[Optogenetics/ja|オプトジェネティクス]]は、非侵襲的な方法で生物学的事象を制御することを可能にする。 この分野は近年、青色光利用FADドメイン(BLUF)のような光感受性を引き起こすものを含む、多くの新しいツールによって進歩している。 BLUFは植物やバクテリアの光受容体に由来する100から140[[amino acid/ja|アミノ酸]]の配列をコードしている。他の[[photoreceptor protein/ja|光受容体]]と同様に、光はBLUFドメインの構造変化を引き起こし、その結果、下流の相互作用が阻害される。現在の研究では、BLUFドメインが付加されたタンパク質と、様々な外部因子がタンパク質にどのような影響を与えるかを調べている。 | |||
[[Optogenetics]] | |||
<span id="Treatment_monitoring"></span> | <span id="Treatment_monitoring"></span> | ||
Latest revision as of 20:56, 10 April 2024
| |

| |
| Identifiers | |
|---|---|
3D model (JSmol)
|
|
| 3DMet | |
| 1208946 | |
| ChEBI | |
| ChEMBL | |
| DrugBank | |
| EC Number |
|
| 108834 | |
| KEGG | |
| MeSH | Flavin-Adenine+Dinucleotide |
PubChem CID
|
|
| UNII | |
| |
| |
| Properties | |
| C27H33N9O15P2 | |
| Molar mass | 785.557 g·mol−1 |
| Appearance | White, vitreous crystals |
| log P | -1.336 |
| Acidity (pKa) | 1.128 |
| Basicity (pKb) | 12.8689 |
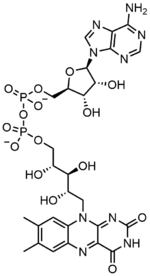
生化学において、フラビンアデニンジヌクレオチド(FAD)は、様々なタンパク質に付随する酸化還元活性の補酵素であり、代謝におけるいくつかの酵素反応に関与する。フラボタンパク質はフラビン基を持つタンパク質であり、FADまたはフラビンモノヌクレオチド(FMN)の形をとる。コハク酸デヒドロゲナーゼ複合体の構成要素、α-ケトグルタル酸デヒドロゲナーゼ、ピルビン酸デヒドロゲナーゼ複合体の構成要素など、多くのフラボタンパク質が知られている。
FADは、フラビン-N(5)-オキシド、キノン、セミキノン、ヒドロキノンの4つの酸化還元状態で存在することができる。FADは電子を受容したり供与したりすることによって、これらの状態の間で変換される。FADは完全に酸化された形、すなわちキノン形では、2個の電子と2個のプロトンを受け入れてFADH2(ハイドロキノン形)となる。セミキノン(FADH-)は、FADの還元か、FADH2の酸化のどちらかによって、それぞれ1個の電子と1個のプロトンを受容するか供与することで形成される。しかし、タンパク質によっては、フラビン補因子の過酸化型、フラビン-N(5)-オキシドを生成し、維持するものもある。
歴史
フラボタンパク質は、1879年に牛乳の成分を分離することによって初めて発見された。当初はその乳由来と黄色の色素からラクトクロムと呼ばれていた。科学界が黄色い色素の原因分子を特定するのに実質的な進歩を遂げるには50年かかった。1930年代には、多くのフラビンとニコチンアミドの誘導体構造が発表され、酸化還元触媒反応におけるそれらの義務的な役割が明らかになり、補酵素の研究分野が始まった。ドイツの科学者オットー・ヴァールブルクとウォルター・クリスチャンは1932年に細胞呼吸に必要な酵母由来の黄色いタンパク質を発見した。彼らの同僚ユーゴ・セオレルはこの黄色い酵素をアポ酵素と黄色い色素に分離し、酵素も色素もNADHを酸化する能力がないが、両者を混ぜ合わせると活性が回復することを示した。テオレルは1937年にこの色素がリボフラビンのリン酸エステルであることを確認した(フラビンモノヌクレオチド(FMN))。それは、酵素補因子の最初の直接的な証拠となった。ワールブルグとクリスチャンは、1938年にも同様の実験を行い、FADがD-アミノ酸オキシダーゼの補因子であることを発見した。ニコチンアミドをヒドリド基転移に結びつけたワールブルグの仕事とフラビンの発見は、40年代から50年代にかけて多くの科学者が大量の酸化還元生化学を発見し、クエン酸サイクルやATP合成などの経路でそれらを結びつける道を開いた。
特性
フラビンアデニンジヌクレオチドは2つの部分からなる:アデニンヌクレオチド(アデノシン一リン酸)とフラビンモノヌクレオチド(FMN)の2つの部分がリン酸基を介して橋渡しされている。アデニンは1'炭素で環状リボースと結合し、リン酸は5'炭素でリボースと結合してアデニンヌクレオチドを形成する。リボフラビンは、イソアロキサジンとリビトールとの間の炭素-窒素(C-N)結合によって形成される。その後、リン酸基は末端のリボース炭素に結合し、FMNを形成する。イソアロキサジンとリビトールの結合はグリコシド結合ではないと考えられているため、フラビンモノヌクレオチドは真のヌクレオチドではない。このため、ジヌクレオチドという名称は誤解を招く。しかし、フラビンモノヌクレオチド基は、その構造と化学的性質において、依然としてヌクレオチドに非常に近い。


FADは2H+と2e-の付加によってFADH2に還元される。FADH2はまた、1つのH+と1つのe-の損失によって酸化され、FADHを形成することができる。FADの形は、1H+と1e-のさらなる損失によって再形成される。FADの形成は、フラビン-N(5)-オキシドの還元と脱水によっても起こりうる。酸化状態に基づいて、フラビンは水溶液中で特定の色をとる。 フラビン-N(5)-オキシド(超酸化型)は黄橙色、FAD(完全酸化型)は黄色、FADH(半還元型)はpHに基づいて青色または赤色、完全還元型は無色である。形を変えると、他の化学的性質に大きな影響を与えることがある。例えば、完全酸化型のFADは求核攻撃を受け、完全還元型のFADH2は高い分極率を持ち、半還元型は水溶液中で不安定である。FADは芳香環系であるが、FADH2はそうではない。これは、芳香族構造がもたらす共鳴による安定化がなく、FADH2のエネルギーが著しく高いことを意味する。 FADH2は、酸化されると芳香族性を取り戻し、この安定化によって表されるエネルギーを放出するので、エネルギーを運ぶ分子である。
FADとその変異体の分光特性は、UV-VIS吸収と蛍光分光法を使用することによる反応のモニタリングを可能にする。FADの各形態は明確な吸光度スペクトルを持ち、酸化状態の変化を容易に観察することができる。FADの主な局所吸光度極大は450 nmに観測され、消衰係数は11,300 M-1cm-1である。フラビンは一般に、結合していないときに蛍光活性を示す(フラビン核酸誘導体と結合したタンパク質はフラボタンパク質と呼ばれる)。この性質は、タンパク質の結合を調べる際に利用することができ、結合状態にすると蛍光活性が失われることを観察することができる。酸化フラビンは約450 nmの高い吸光度を持ち、約515-520 nmで蛍光を発する。
化学状態
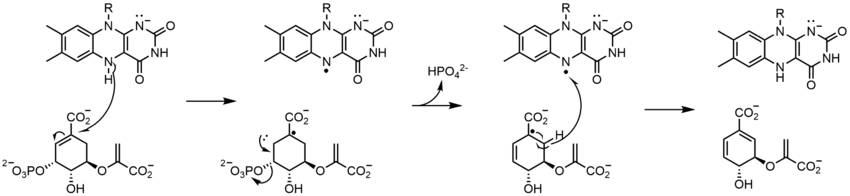
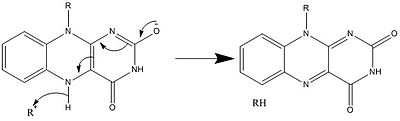
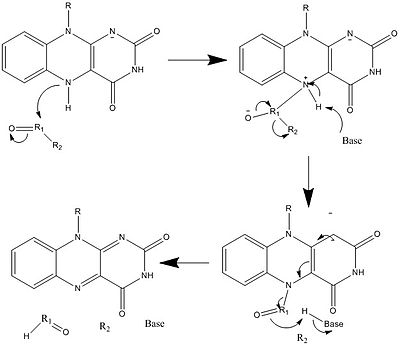
生物学的システムでは、FADは完全に酸化された形態ではH+とe-の受容体として、FADHの形態では受容体または供与体として、還元されたFADH2の形態では供与体として働く。下の図は、この物質が受ける可能性のある変化をまとめたものである。
上に見たものの他に、FADの他の反応性形態が形成されたり消費されたりすることもある。これらの反応は、電子の移動と化学結合の生成/切断を伴う。反応機構を通して、FADは生物システム内の化学活動に貢献することができる。以下の写真は、FADが関与しうるいくつかの作用の一般的な形を表している。
メカニズム1と2はヒドリド獲得を表し、分子は1つのヒドリドイオンとなるものを獲得する。メカニズム3と4はラジカル生成とヒドリド喪失を表す。ラジカル種は不対電子原子を含み、非常に化学的に活性である。ヒドリド損失は、前に見たヒドリド獲得の逆過程である。最後の2つの機構は、求核付加と炭素ラジカルを用いた反応である。
 |
 |
 |
 |
 |
 |
生合成
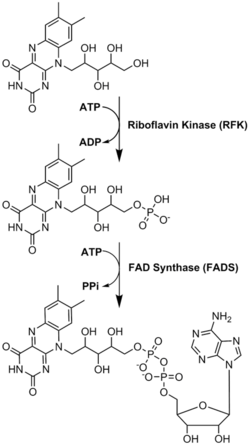
FADは、リボフラビンに由来するもう一つの分子であるフラビンモノヌクレオチドとともに、酵素補因子として主要な役割を果たしている。細菌、菌類、植物はリボフラビンを作ることができるが、ヒトのような他の真核生物は作る能力を失っている。そのため、ヒトはビタミンB2としても知られるリボフラビンを食事から摂取しなければならない。リボフラビンは一般的に小腸で摂取され、その後キャリアタンパク質を介して細胞に輸送される。リボフラビンキナーゼ(EC 2.7.1.26)は、リボフラビンにリン酸基を付加してフラビンモノヌクレオチドを生成し、次に|FAD合成酵素がアデニンヌクレオチドを付加する;両ステップともATPを必要とする。細菌は通常1つの2機能酵素を持つが、古細菌や真核生物は通常2つの異なる酵素を用いる。現在の研究では、異なるアイソフォームが細胞質とミトコンドリアに存在することが示されている。FADは両方の場所で合成され、必要な場所に運ばれる可能性があるようだ。
機能
フラビンタンパク質は、フラビン部分のユニークで多様な構造を利用して、難しい酸化還元反応を触媒する。 フラビンは複数の酸化還元状態を持つため、1個または2個の電子、水素原子、またはヒドロニウムイオンの移動を伴うプロセスに関与することができる。 完全に酸化されたフラビン環のN5とC4aは求核攻撃を受けやすい。フラビン部分のこのような多様なイオン化と修飾は、イソアロキサジン環系と、フラビンアデニンジヌクレオチド(FAD)を含むフラビンの結合時の速度論的パラメーターを劇的に変化させるフラビンタンパク質の能力に起因している。
ゲノム(フラボプロテオーム)中のフラビン依存性タンパク質をコードする遺伝子の数は種によって異なり、0.1%〜3.5%で、ヒトは90のフラボプロテインをコードする遺伝子を持つ。FADはフラビンのより複雑で豊富な形態であり、フラボプロテオーム全体の75%、ヒトがコードするフラボタンパク質の84%に結合していると報告されている。 様々な哺乳類培養細胞株における遊離または非共有結合フラビンの細胞内濃度は、FAD(2.2-17.0 amol/cell)とFMN(0.46-3.4 amol/cell)で報告されている。
FADはNAD+よりも正の還元電位を持ち、非常に強い酸化剤である。細胞はこれを、C-C結合のアルケンへの脱水素反応など、エネルギー的に困難な多くの酸化反応に利用する。FAD依存性タンパク質は、電子輸送、DNA修復、ヌクレオチド生合成、脂肪酸のβ酸化、アミノ酸異化、さらにCoA、CoQ、ヘム基などの他の補因子の合成など、多種多様な代謝経路で機能している。 よく知られている反応の1つはクエン酸サイクル(TCAまたはクレブスサイクルとしても知られている)の一部である。コハク酸デヒドロゲナーゼ(電子伝達系の複合体II)は、ユビキノンのユビキノールへの還元と結合させることによってコハク酸のフマル酸への酸化を触媒するために共有結合したFADを必要とする。この酸化による高エネルギー電子は、FADをFADH2に還元することによって一時的に蓄えられる。FADH2はその後FADに戻り、その2つの高エネルギー電子を電子伝達系に送る。FADH2のエネルギーは、酸化的リン酸化によって1.5当量のATPを生成するのに十分である。いくつかの酸化還元フラボ蛋白質は、アセチルCoAデヒドロゲナーゼのようにFADと非共有結合し、脂肪酸のβ酸化やロイシンのようなアミノ酸の異化に関与する(イソバレリルCoAデヒドロゲナーゼ)、 イソロイシン(短鎖/分岐鎖アシル-CoAデヒドロゲナーゼ)、バリン(イソブチリル-CoAデヒドロゲナーゼ)、およびリジン(グルタリル-CoAデヒドロゲナーゼ)のようなアミノ酸の異化を行う。 代謝を制御するFAD依存性酵素のその他の例としては、グリセロール-3-リン酸デヒドロゲナーゼ(トリグリセリド合成)とプリンヌクレオチド異化に関与するキサンチンオキシダーゼがある。 フラボタンパク質においてFADが果たしうる非触媒的機能としては、構造的役割、あるいは生物時計や発生を制御する青感受性の光光受容体への関与、生物発光細菌における光の発生などがある。
フラボタンパク質
フラボタンパク質は、FMNまたはFAD分子を補欠基として持ち、この補欠基は強固に結合しているか共有結合している。共有結合したFADを持つフラボ蛋白質は5-10%程度しかないが、これらの酵素はより強い酸化還元力を持つ。場合によっては、FADは活性部位を構造的に支持したり、触媒反応中の中間体を安定化させたりする。利用可能な構造データに基づいて、既知のFAD結合部位は200以上のタイプに分けられる。
ヒトゲノムには90のフラボタンパク質がコードされており、約84%はFADを、約16%はFMNを必要とする。フラボタンパク質は主にミトコンドリアに存在する。フラボタンパク質のうち90%は酸化還元反応を行い、残りの10%は転移酵素、リアーゼ、異性化酵素、リガーゼである。
炭素-ヘテロ原子結合の酸化
炭素-窒素
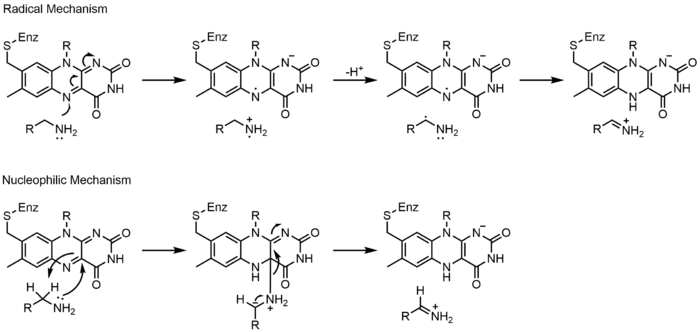
モノアミン酸化酵素(MAO)は、ノルエピネフリン、セロトニン、ドーパミンの異化における生物学的重要性から、広く研究されているフラボ酵素である。MAOは一級、二級、三級アミンを酸化し、非酵素的にイミンからアルデヒドやケトンに加水分解する。このクラスの酵素は広く研究されているが、その作用機序についてはまだ議論が続いている。ラジカル機構と求核機構である。ラジカル機構は、ラジカル中間体の存在を示すスペクトルや電子常磁性共鳴の証拠が存在しないため、あまり一般的には受け入れられていない。求核機構は、基質の求核性を高めると予想される2つのチロシン残基を変異させた部位特異的突然変異誘発研究によって支持されているため、より支持されている。
炭素-酸素
グルコースオキシダーゼ(GOX)は、β-D-グルコースのD-グルコノ-δ-ラクトンへの酸化を触媒し、同時に酵素結合フラビンを還元する。GOXはホモ二量体として存在し、各サブユニットが1個のFAD分子を結合している。結晶構造から、FADは二量体界面近くの酵素の深いポケットに結合していることがわかった。研究により、FADを8-ヒドロキシ-5-カルバ-5-デアザFADで置換すると、フラビンのre面と反応して反応の立体化学が決定されることが示された。ターンオーバーの際、中性および陰イオンのセミキノンが観察され、ラジカル機構が示唆された。
炭素-硫黄
プレニルシステインリアーゼ(PCLase)は、プレニルシステイン(タンパク質修飾)の切断を触媒し、イソプレノイドアルデヒドとタンパク質標的上の遊離システイン残基を形成する。FADはPCLaseと非共有結合している。フラビンの反応を調べるメカニズム研究はあまり行われていないが、提案されているメカニズムを以下に示す。プレニル部分のC1からFADへのヒドリド転移が提案され、その結果フラビンはFADH2に還元される。 COformEDは隣の硫黄原子によって安定化されたカルボカチオンである。その後、FADH2は分子状酸素と反応して酸化酵素を回復させる。
炭素-炭素
UDP-N-acetylenolpyruvylglucosamine Reductase (MurB) は、エノールピルビル-UDP-N-アセチルグルコサミン(基質)をNADPHに依存して、対応するD-ラクチル化合物UDP-N-アセチルムラミン酸(生成物)に還元する反応を触媒する酵素である。MurBは単量体であり、FAD分子を1つ含む。基質が生成物に変換される前に、NADPHはまずFADを還元しなければならない。NADP+が解離すると、基質が結合し、還元されたフラビンが生成物を還元することができる。
チオール/ジスルフィド化学
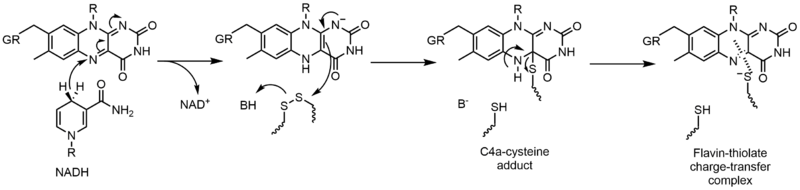
グルタチオン還元酵素(GR)は、グルタチオンジスルフィド(GSSG)からグルタチオン(GSH)への還元反応を触媒する。GRはこの反応を促進するためにFADとNADPHを必要とする。まず、水素化物がNADPHからFADに移動しなければならない。次に、還元されたフラビンが求核剤として作用してジスルフィドを攻撃することができ、これがC4a-システイン付加体を形成する。この付加体が除去されると、フラビン-チオレート電荷移動錯体が形成される。
電子移動反応
モノオキシゲナーゼ(水酸化)反応を触媒するシトクロムP450型酵素は、FADからP450への2個の電子の移動に依存している。真核生物には2種類のP450システムが存在する。小胞体に存在するP450システムは、FADとFMNの両方を含むシトクロムP-450還元酵素(CPR)に依存している。還元されたFAD(FADH2)上の2つの電子は1つずつFMNに移動し、その後1つの電子がFMNからP450のヘムに渡される。
ミトコンドリアに存在するP450システムは、2つの電子伝達タンパク質に依存している: FADを含むアドレノドキシン還元酵素(AR)と、アドレノドキシンと名付けられた小さな鉄硫黄基含有タンパク質である。FADはARのFAD結合ドメインに埋め込まれている。ARのFADは、ARのNADP結合ドメインに結合しているNADPHから2つの電子が移動することにより、FADH2に還元される。この酵素の構造は、効率的な電子伝達のために電子供与体NADPHと受容体FADの位置関係を正確に保つために高度に保存されている。還元されたFADの2個の電子はアドレノドキシンに1個ずつ移動し、アドレノドキシンはミトコンドリアP450のヘム基に1個の電子を供与する。
ミクロソームの還元酵素とミトコンドリアのP450システムの還元酵素の構造は全く異なり、相同性を示さない。
酸化還元
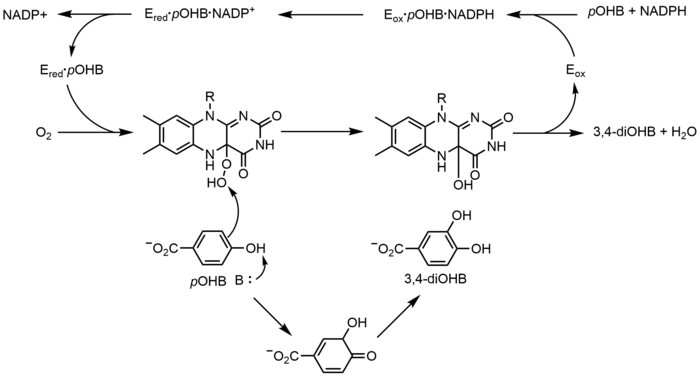
p-ヒドロキシ安息香酸ヒドロキシラーゼ(PHBH)は、p-ヒドロキシ安息香酸(pOHB)から3,4-ジヒドロキシ安息香酸(3,4-ジOHB)への酸素化を触媒する。この反応にはFAD、NADPH、分子状酸素がすべて必要である。NADPHはまずFADに水素化物当量を移動させ、FADH-を作り、次にNADP+は酵素から解離する。還元されたPHBHは分子状酸素と反応してフラビン-C(4a)-ヒドロペルオキシドを形成する。フラビンヒドロペルオキシドは速やかにpOHBをヒドロキシル化し、水分を除去して酸化フラビンを再生する。フラビンを介した別の酸素化機構としては、フラビン-C(4a)-(ヒドロ)ペルオキシドではなく、フラビン-N(5)-オキシドを用いる方法がある。
非酸化還元
コリスメート合成酵素(CS)は、シキメート経路の最後の段階であるコリスメート形成を触媒する。2種類のCSが知られており、どちらもFMNを必要とするが、還元剤としてNADPHを必要とするかどうかで分かれる。CSのメカニズムとして提案されているのは、ラジカル種である。ラジカルフラビン種は、基質アナログを用いなければ分光学的に検出されておらず、短命であることが示唆されている。しかし、フッ素化基質を用いると、中性のフラビンセミキノンが検出された。
複合フラボ酵素
グルタミン酸合成酵素は、L-グルタミンを窒素源として、2-オキソグルタル酸からL-グルタミン酸への変換を触媒する。全てのグルタミン酸合成酵素は、鉄-硫黄クラスターとFMNを含む鉄-硫黄フラボ蛋白質である。グルタミン酸合成の3つのクラスは、その配列と生化学的性質に基づいて分類される。この酵素には3つのクラスがあるとはいえ、最初にFMNを還元するものが異なるだけで、すべて同じメカニズムで作動すると考えられている。1つはグルタミンの加水分解(グルタミン酸とアンモニアを形成)により、もう1つは最初の反応から生じたアンモニアが2-オキソグルタル酸を攻撃することにより、FMNによってグルタミン酸に還元される。
臨床的意義
フラボタンパク質関連疾患
フラボタンパク質の重要性から、ヒトのフラボタンパク質の約60%が変異するとヒトの病気を引き起こすことは当然である。場合によっては、FADまたはFMNに対する親和性が低下するため、リボフラビンの過剰摂取が多重アシル-CoAデヒドロゲナーゼ欠損症のような疾患症状を軽減することがある。さらに、リボフラビン欠乏症そのもの(およびその結果生じるFADとFMNの欠乏)が健康問題を引き起こすこともある。例えば、ALS患者では、FAD合成のレベルが低下している。これらの経路はどちらも、発育や胃腸の異常、誤った脂肪分解、貧血、神経学的問題、癌や心臓病、偏頭痛、視力の悪化、皮膚病変など、さまざまな症状を引き起こす。そのため製薬業界は、特定の場合に食事を補うためにリボフラビンを製造している。 2008年、リボフラビンの世界的ニーズは年間6,000トンで、生産能力は10,000トンであった。この1億5,000万ドルから5億ドルの市場は、医療用途だけでなく、農業分野では動物性食品の補助食品として、また食用色素としても使用されている。
薬物デザイン
一般的な抗生物質に対する耐性菌が増加する中、抗細菌医薬品の新たなデザインは科学研究において引き続き重要である。 FADを使用する特定の代謝タンパク質(複合体II)は細菌の病原性に不可欠であるため、FAD合成を標的にしたり、FADアナログを作ったりすることは有用な研究分野となりうる。すでに科学者たちは、FADが結合すると通常とる2つの構造を決定している。1つは伸長したコンフォメーション、もう1つはバタフライコンフォメーションで、このコンフォメーションでは分子が実質的に半分に折れ曲がり、アデニン環とイソアロキサジン環が積み重なる。 同様の方法で結合できるが、タンパク質の機能を阻害しないFAD模倣体は、細菌感染を阻害する有用なメカニズムとなりうる。ヒトと細菌のFAD合成は非常に異なる酵素に依存しているため、細菌のFAD合成酵素を標的にした薬物がヒトのFAD合成酵素を阻害する可能性は低い。
光遺伝学
オプトジェネティクスは、非侵襲的な方法で生物学的事象を制御することを可能にする。 この分野は近年、青色光利用FADドメイン(BLUF)のような光感受性を引き起こすものを含む、多くの新しいツールによって進歩している。 BLUFは植物やバクテリアの光受容体に由来する100から140アミノ酸の配列をコードしている。他の光受容体と同様に、光はBLUFドメインの構造変化を引き起こし、その結果、下流の相互作用が阻害される。現在の研究では、BLUFドメインが付加されたタンパク質と、様々な外部因子がタンパク質にどのような影響を与えるかを調べている。
治療モニタリング
体内には、トリプトファン、collagen/jaコラーゲン、FAD、NADH、ポルフィリンなど、固有の蛍光を持つ分子が数多く存在する。 科学者たちはこれを利用して、病気の進行や治療効果をモニターしたり、診断に役立てたりしている。 例えば、FADとNADHのネイティブ蛍光は正常組織と口腔粘膜下線維症で異なる。これは浸潤性口腔癌の初期徴候である。そのため医師は、標準的な生検とは対照的に、診断の補助や治療のモニタリングに蛍光を採用している。
その他の画像
-
FADH2
こちらも参照
外部リンク
- FAD bound to proteins in the PDB
- FAD entry in the NIH Chemical Database