Dipeptidyl peptidase-4/ja: Difference between revisions
Created page with "== 外部リンク == * The MEROPS online database for peptidases and their inhibitors: [http://merops.sanger.ac.uk/cgi-bin/merops.cgi?id=S09.003 S09.003] * {{MeshName|Dipeptidyl-Peptidase+IV}} * {{UTGlucagon|dpp4}}" |
Created page with "DPP4、あるいはそのマイコバクテリア・ホモログであるMtDPPは、ケモカインC-X-Cモチーフ・ケモカイン・リガンド10(CXCL10)の切断を介して、結核の病因に関与している可能性がある。" |
||
| (9 intermediate revisions by the same user not shown) | |||
| Line 2: | Line 2: | ||
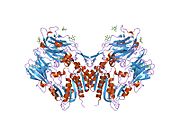
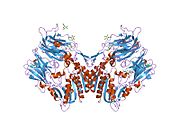
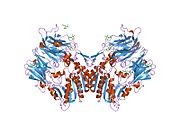
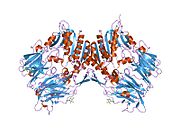
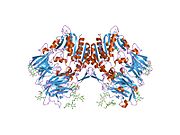
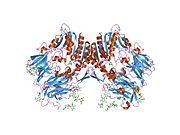
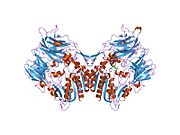
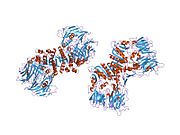
'''ジペプチジルペプチダーゼ-4'''('''DPP4'''または'''DPPIV''')は、'''アデノシンデアミナーゼ複合体化タンパク質2'''または'''CD26'''([[cluster of differentiation/ja|分化クラスタ]]26)としても知られる[[protein/ja|タンパク質]]である。DPP4は[[FAP (gene)/ja|FAP]]、[[DPP8/ja|DPP8]]、[[DPP9/ja|DPP9]]と関連している。この酵素は1966年にHopsu-HavuとGlennerによって発見され、化学的な様々な研究の結果、ジペプチジルペプチダーゼIV [DP IV]と呼ばれるようになった。 | '''ジペプチジルペプチダーゼ-4'''('''DPP4'''または'''DPPIV''')は、'''アデノシンデアミナーゼ複合体化タンパク質2'''または'''CD26'''([[cluster of differentiation/ja|分化クラスタ]]26)としても知られる[[protein/ja|タンパク質]]である。DPP4は[[FAP (gene)/ja|FAP]]、[[DPP8/ja|DPP8]]、[[DPP9/ja|DPP9]]と関連している。この酵素は1966年にHopsu-HavuとGlennerによって発見され、化学的な様々な研究の結果、ジペプチジルペプチダーゼIV [DP IV]と呼ばれるようになった。 | ||
== 機能 == | |||
{{Anchor|Function}} | |||
''DPP4''遺伝子によってコードされるタンパク質は、ほとんどの細胞種の表面に発現する[[enzyme/ja|酵素]]であり、免疫調節、[[signal transduction/ja|シグナル伝達]]、および[[apoptosis/ja|アポトーシス]]に関連している。DPP-4はII型膜貫通[[glycoprotein/ja|糖タンパク質]]であるが、細胞内と膜貫通部分を欠いた可溶型が血漿や様々な体液中に存在する。DPP-4は[[polypeptide/ja|ポリペプチド]]の[[N末端]]からX-プロリンまたはX-アラニン[[dipeptide/ja|ジペプチド]]を切断する[[serine/ja|セリン]][[exopeptidase/ja|エキソペプチダーゼ]]である。 | |||
環状アミノ酸であるプロリンを含むペプチド結合はプロテアーゼの大部分では切断できず、N末端のX-プロリンは様々な生体ペプチドを「シールド」する。したがって、細胞外プロリン特異的プロテアーゼは、これらの生体ペプチドの制御において重要な役割を果たしている。 | |||
DPP-4は[[growth factor/ja|成長因子]]、[[chemokine/ja|ケモカイン]]、[[neuropeptide/ja|神経ペプチド]]、[[vasoactive/ja|血管作動性]]ペプチドを含む広範囲の[[Substrate (biochemistry)/ja|基質]]を切断することが知られている。ほとんどの場合、切断された基質は生物学的活性を失うが、ケモカインのRANTESと神経ペプチドYの場合、DPP-4を介した切断は受容体のサブタイプ結合のシフトをもたらす。 | |||
DPP- | |||
DPP4は[[glucose/ja|グルコース]]代謝において主要な役割を果たしている。[[glucagon-like peptide-1/ja|GLP-1]]などの[[incretin/ja|インクレチン]]の分解を担っている。さらに、いくつかの[[tumors/ja|腫瘍]]の発生において抑制因子として働いているようである。 | |||
DPP-4はまた、酵素[[adenosine deaminase/ja|アデノシンデアミナーゼ]]と特異的かつ高い親和性で結合する。この相互作用の重要性はまだ確立されていない。 | |||
DPP- | |||
==動物研究== | |||
{{Anchor|Animal studies}} | |||
動物実験では、肝臓や腎臓など様々な臓器の[[fibrosis/ja|線維症]]の発症に関与していることが示唆されている。 | |||
== 臨床的意義 == | |||
{{Anchor|Clinical significance}} | |||
CD26/DPPIVは腫瘍生物学において重要な役割を担っており、様々な癌のマーカーとして有用であり、細胞表面または血清中のそのレベルは、ある[[neoplasm/ja|新生物]]では増加し、他の新生物では減少する。 | |||
CD26/ | |||
[[dipeptidyl peptidase-4 inhibitors/ja|ジペプチジルペプチダーゼ-4阻害薬]]と呼ばれる[[oral hypoglycemics/ja|経口血糖降下薬]]の一種は、この酵素の作用を阻害することによって機能し、それによって[[incretin/ja|インクレチン]]効果を''生体内''で延長させる。 | |||
[[Middle East respiratory syndrome coronavirus/ja|中東呼吸器症候群コロナウイルス]]はDPP4に結合することが分かっている。 DPP4は肺などの気道や腎臓の細胞表面に存在する。科学者たちは、ウイルスが細胞内に侵入するのを阻止することで、これを利用できるかもしれない。 | |||
[[Middle East respiratory syndrome coronavirus]] | |||
DPP4、あるいはそのマイコバクテリア・ホモログであるMtDPPは、[[chemokine/ja|ケモカイン]]C-X-Cモチーフ・ケモカイン・リガンド10([[CXCL10/ja|CXCL10]])の切断を介して、[[tuberculosis/ja|結核]]の病因に関与している可能性がある。 | |||
== こちらも参照 == | == こちらも参照 == | ||
Latest revision as of 08:58, 12 March 2024
ジペプチジルペプチダーゼ-4(DPP4またはDPPIV)は、アデノシンデアミナーゼ複合体化タンパク質2またはCD26(分化クラスタ26)としても知られるタンパク質である。DPP4はFAP、DPP8、DPP9と関連している。この酵素は1966年にHopsu-HavuとGlennerによって発見され、化学的な様々な研究の結果、ジペプチジルペプチダーゼIV [DP IV]と呼ばれるようになった。
機能
DPP4遺伝子によってコードされるタンパク質は、ほとんどの細胞種の表面に発現する酵素であり、免疫調節、シグナル伝達、およびアポトーシスに関連している。DPP-4はII型膜貫通糖タンパク質であるが、細胞内と膜貫通部分を欠いた可溶型が血漿や様々な体液中に存在する。DPP-4はポリペプチドのN末端からX-プロリンまたはX-アラニンジペプチドを切断するセリンエキソペプチダーゼである。 環状アミノ酸であるプロリンを含むペプチド結合はプロテアーゼの大部分では切断できず、N末端のX-プロリンは様々な生体ペプチドを「シールド」する。したがって、細胞外プロリン特異的プロテアーゼは、これらの生体ペプチドの制御において重要な役割を果たしている。
DPP-4は成長因子、ケモカイン、神経ペプチド、血管作動性ペプチドを含む広範囲の基質を切断することが知られている。ほとんどの場合、切断された基質は生物学的活性を失うが、ケモカインのRANTESと神経ペプチドYの場合、DPP-4を介した切断は受容体のサブタイプ結合のシフトをもたらす。
DPP4はグルコース代謝において主要な役割を果たしている。GLP-1などのインクレチンの分解を担っている。さらに、いくつかの腫瘍の発生において抑制因子として働いているようである。
DPP-4はまた、酵素アデノシンデアミナーゼと特異的かつ高い親和性で結合する。この相互作用の重要性はまだ確立されていない。
動物研究
動物実験では、肝臓や腎臓など様々な臓器の線維症の発症に関与していることが示唆されている。
臨床的意義
CD26/DPPIVは腫瘍生物学において重要な役割を担っており、様々な癌のマーカーとして有用であり、細胞表面または血清中のそのレベルは、ある新生物では増加し、他の新生物では減少する。
ジペプチジルペプチダーゼ-4阻害薬と呼ばれる経口血糖降下薬の一種は、この酵素の作用を阻害することによって機能し、それによってインクレチン効果を生体内で延長させる。
中東呼吸器症候群コロナウイルスはDPP4に結合することが分かっている。 DPP4は肺などの気道や腎臓の細胞表面に存在する。科学者たちは、ウイルスが細胞内に侵入するのを阻止することで、これを利用できるかもしれない。
DPP4、あるいはそのマイコバクテリア・ホモログであるMtDPPは、ケモカインC-X-Cモチーフ・ケモカイン・リガンド10(CXCL10)の切断を介して、結核の病因に関与している可能性がある。
こちらも参照
さらに読む
- Ansorge S, Bühling F, Kähne T, Lendeckel U, Reinhold D, Täger M, Wrenger S (1997). "CD26/Dipeptidyl Peptidase IV in Lymphocyte Growth Regulation". Cellular Peptidases in Immune Functions and Diseases. Advances in Experimental Medicine and Biology. 421. pp. 127–40. doi:10.1007/978-1-4757-9613-1_17. ISBN 978-1-4757-9615-5. PMID 9330689.
- Reinhold D, Kähne T, Steinbrecher A, Wrenger S, Neubert K, Ansorge S, Brocke S (2003). "The role of dipeptidyl peptidase IV (DP IV) enzymatic activity in T cell activation and autoimmunity". Biological Chemistry. 383 (7–8): 1133–8. doi:10.1515/BC.2002.123. PMID 12437097. S2CID 30027839.
- de Meester I, Lambeir AM, Proost P, Scharpé S (2003). "Dipeptidyl Peptidase IV Substrates". Dipeptidyl Aminopeptidases in Health and Disease. Advances in Experimental Medicine and Biology. 524. pp. 3–17. doi:10.1007/0-306-47920-6_1. ISBN 0-306-47717-3. PMID 12675218.
- Koch S, Anthonsen D, Skovbjerg H, Sjöström H (2003). "On the role of dipeptidyl peptidase IV in the digestion of an immunodominant epitope in celiac disease". Dipeptidyl Aminopeptidases in Health and Disease. Advances in Experimental Medicine and Biology. 524. pp. 181–7. doi:10.1007/0-306-47920-6_22. ISBN 0-306-47717-3. PMID 12675238.
- Pro B, Dang NH (October 2004). "CD26/dipeptidyl peptidase IV and its role in cancer". Histology and Histopathology. 19 (4): 1345–51. doi:10.14670/HH-19.1345. PMID 15375776.
外部リンク
- The MEROPS online database for peptidases and their inhibitors: S09.003
- Dipeptidyl-Peptidase+IV at the U.S. National Library of Medicine Medical Subject Headings (MeSH)
- Banting and Best Diabetes Centre at UT dpp4